Aminok
Osztályozás és nómenklatúra
Az aminok az ammónia szerves származékai, amelyek molekulájában egy, két vagy három hidrogénatomot gyökök helyettesítenek. Ennek alapján megkülönböztetik elsődleges (RNH 2), másodlagos (R2NH) és harmadlagos (R 3 N) aminok.
A gyök természetétől függően az aminok lehetnek telítettek vagy aromásak, valamint telített aromásak (metil-amin, anilin és metil-anilin). Az elágazó láncú gyök nitrogénatomhoz is kapcsolódhat (pl. dörzsöli butil-amin) és polikondenzált, amint azt az adamantilamin (aminoadamantán) példája mutatja, amely biológiai hatású és az orvostudományban használatos


A racionális nómenklatúra elvei szerint ennek az anyagosztálynak a neve a nitrogénatomnál lévő gyökök nevéből áll, ún. amin. A primer aminok nemzetközi nómenklatúra szerinti elnevezésében az amin nitrogénatomja a név ami-De,úgy használjuk, hogy a szénhidrogénlánc neve előtt megjelöljük a helyét. Sok amin azonban megtartotta triviális nevét, pl. anilin".
A szerves anyagok molekulái az aminocsoporton kívül más szubsztituenseket is tartalmazhatnak, mint például a szulfanilsav esetében. Az amin nitrogénatomja a telített gyűrűben is szerepelhet. A telített heterociklusos aminok között van egy háromtagú, feszültséggel felépített szerkezet etilén-imin, erős mutagén hatású. Az etilénimin gyűrű egyes gyógyszerek molekuláinak része. Számos alkaloid (beleértve a nikotint és az anabazint, lásd a 20.4. szakaszt) molekuláiban jelenlévő tetrahidropirrol és piperidin gyűrűk feszültség nélkül épülnek fel. Közreműködésükkel, valamint a morfolingyűrű segítségével számos gyógyszer molekulája épül fel.




Heterociklusos aromás aminok például a pirrol és a piridin. Végül az aminocsoport egy heterociklushoz is kapcsolódhat, amint azt az adenin (6-aminopurin) példája illusztrálja, amely a nukleinsavak esszenciális fragmense.


Az ammóniaszármazékok közé tartoznak azok a szerves anyagok is, amelyek ammóniumsókból vagy annak hidroxidjából állíthatók elő úgy, hogy mind a négy hidrogénatomot különféle szénhidrogén gyökökkel helyettesítik, amint az a tetrametilammónium-hidroxid példáján látható:

Egy másik példa a tetraszubsztituált ammóniumszármazékokra - kvaterner ammóniumbázisokra vagy sóikra - neurin, az állati szövetek bomlása során keletkező mérgező anyag.
A kvaterner nitrogénatom heterociklusok része lehet, például a piridin sorozat megfelelő sója - N-alkil-piridiniumsó. Az ilyen kvaterner sók közé tartozik néhány alkaloid. Ezenkívül a kvaterner nitrogénatom számos gyógyászati anyagban és néhány biomolekulában megtalálható.
A fenti példák bemutatják az aminovegyületek sokféleségét és nagy orvosi és biológiai jelentőségét. Ehhez hozzá kell tenni, hogy az aminocsoport a biomolekulák olyan osztályainak része, mint az aminosavak és a fehérjék, a nukleinsavak, és számos természetes szénhidrát származékban, az úgynevezett aminocukrokban megtalálható. Az aminocsoport az alkaloidok és számos különféle célú gyógyszer legfontosabb funkcionális csoportja. Az alábbiakban néhány példát mutatunk be ilyen anyagokra.
24.3.2. Aminok, mint szerves bázisok

 A nitrogén szabad elektronpárjának jelenléte az aminoknak a bázisok tulajdonságait adja. Ezért az aminok jellemző tulajdonsága a savakkal való reakció a megfelelő ammóniumsók előállítására, amint az a primer telített amin reakciójából látható:
A nitrogén szabad elektronpárjának jelenléte az aminoknak a bázisok tulajdonságait adja. Ezért az aminok jellemző tulajdonsága a savakkal való reakció a megfelelő ammóniumsók előállítására, amint az a primer telített amin reakciójából látható:
Hasonlóképpen az anilin az anilinből, a piridiniumsó a piridinből stb. Az ammóniához hasonlóan a vizes oldatokban lévő aminok lúgos környezetet hoznak létre, az egyenlet szerint:
Mennyiségileg a nitrogéntartalmú bázisok bázikusságát a vízi környezetben az egyensúlyi állandó értéke tükrözi. (NAK NEK b ) (gyakrabban használják az értéket rK b ) yl/С а (ВН +), amely egy adott bázis konjugált savának savasságát jellemzi.

A legerősebb bázisok azok a nitrogénatomot tartalmazó vegyületek lesznek, amelyekben a magányos nitrogénpár a magányos 5p 3 hibrid pályán található (alifás aminok, ammónia, aminosavak), a leggyengébbek pedig azok, amelyekben ez a pár részt vesz a p-ben. ,n konjugáció (amidok, pirrol, piridin).
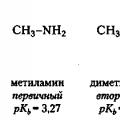
Az alkilcsoportokat tartalmazó elektrondonor szubsztituenseknek növelniük kell az aminok bázikusságát, mivel növelik az elektronsűrűséget a nitrogénatomon. Igen, metil-amin (pK b = 3.27) erősebb bázis, mint az ammónia (pK b = 4,75) és dimetil-amin (pK b = 3,02) erősebb bázis, mint a metil-amin. A trimetil-aminra való áttéréskor azonban a várttal ellentétben a bázikusság enyhén csökken (pK b = 4,10). Ennek az az oka, hogy a nitrogénatomon lévő szubsztituensek számának növekedésével a proton megközelítése egyre nehezebbé válik. Tehát itt nem a szubsztituensek elektronikus, hanem térbeli hatásáról van szó. A szubsztituensek ezen hatását ún sztérikus tényező.
Az aromás aminok az aromás gyűrű elektronvonó hatása miatt gyengébb bázisok, mint a telítettek. Ezért a piridin bázikussága is alacsony. A fenilszubsztituensek felhalmozódása észrevehetően elnyomja a nitrogénatom elektronpárjának aktivitását. Így, rK, A difenil-amin értéke 13,12, a trifenil-amin pedig egyáltalán nem rendelkezik bázis tulajdonságaival.
A pirrol rendkívül alacsony bázikusságát az okozza, hogy molekulájában a nitrogénatom elektronpárja részt vesz a b-elektron aromás kötés kialakításában. Protonnal való megkötése jelentős többletenergia ráfordítást igényel. A pirroliumsók képződése következtében az aromás kötés, és ennek következtében a molekula stabilitása megszűnik. Ez magyarázza azt a tényt, hogy a pirrol savas környezetben gyorsan gyantássá válik.
Érdekes megjegyezni, hogy a pirrolgyűrű erős elektronvonó hatása a nitrogénatomon az N-H kötés gyengüléséhez vezet, aminek következtében a pirrol képes a gyenge sav tulajdonságait kifejteni. (pK A = 17,5).
![]()
Ilyen aktív fém, például kálium hatására káliumsója, a pirrol-kálium állítható elő.
A pirrolgyűrű N-H kötésének savas tulajdonságai magyarázzák különösen a porfin és természetes származékainak azon képességét, hogy fémkationokkal sókat képeznek. A porfirinmolekula két pirrolgyűrűje a nitrogénatomok elektronpárjainak köszönhetően koordinálódik a kationnal, a másik kettő pedig a hidrogénatomok cseréjével koordinálódik, mint maga a pirrolmolekula a pirrol-kálium képződése során. Ezek a sók a klorofill és a hemoglobin.

A szénhidrogén szubsztituensek természete alapján az aminokat a következőkre osztjuk
Az aminok általános szerkezeti jellemzői
Csakúgy, mint az ammónia molekulában, bármely amin molekulájában a nitrogénatomnak van egy magányos elektronpárja, amely a torz tetraéder egyik csúcsára irányul:
Emiatt az aminok, mint az ammónia, jelentősen kifejezett bázikus tulajdonságokkal rendelkeznek.
Így az aminok, hasonlóan az ammóniához, reverzibilisen reagálnak vízzel, gyenge bázisokat képezve:
A hidrogénkation és a nitrogénatom közötti kötés az amin molekulában a nitrogénatom magányos elektronpárja miatt donor-akceptor mechanizmus segítségével valósul meg. A telített aminok erősebb bázisok az ammóniához képest, mert az ilyen aminokban a szénhidrogén szubsztituensek pozitív induktív (+I) hatást fejtenek ki. Ebben a tekintetben a nitrogénatom elektronsűrűsége nő, ami megkönnyíti a H + kationnal való kölcsönhatását.
Az aromás aminok, ha az aminocsoport közvetlenül kapcsolódik az aromás gyűrűhöz, gyengébb bázikus tulajdonságokat mutatnak az ammóniához képest. Ennek az az oka, hogy a nitrogénatom magányos elektronpárja a benzolgyűrű aromás π-rendszere felé tolódik el, aminek következtében a nitrogénatomon csökken az elektronsűrűség. Ez viszont az alapvető tulajdonságok csökkenéséhez vezet, különösen a vízzel való kölcsönhatás képességének csökkenéséhez. Például az anilin csak erős savakkal reagál, de vízzel gyakorlatilag nem.
Telített aminok kémiai tulajdonságai
Mint már említettük, az aminok reverzibilisen reagálnak a vízzel:
Az aminok vizes oldatai lúgos reakciót mutatnak a keletkező bázisok disszociációja miatt:
A telített aminok erősebb bázikus tulajdonságaik miatt jobban reagálnak a vízzel, mint az ammónia.
A telített aminok alapvető tulajdonságai a sorozatban növekednek.
A szekunder telített aminok erősebb bázisok, mint a primer telített aminok, amelyek viszont erősebbek, mint az ammónia. Ami a tercier aminok alapvető tulajdonságait illeti, ha vizes oldatokban végbemenő reakciókról beszélünk, akkor a tercier aminok alapvető tulajdonságai sokkal rosszabbul fejeződnek ki, mint a szekunder aminoké, sőt valamivel rosszabbul is, mint a primer aminoké. Ennek oka a sztérikus akadályok, amelyek jelentősen befolyásolják az amin protonálódási sebességét. Más szavakkal, három szubsztituens „blokkolja” a nitrogénatomot, és megzavarja a H + kationokkal való kölcsönhatását.
Kölcsönhatás savakkal
A szabad telített aminok és vizes oldataik egyaránt reagálnak savakkal. Ebben az esetben sók képződnek:
Mivel a telített aminok bázikus tulajdonságai kifejezettebbek, mint az ammóniáé, az ilyen aminok még gyenge savakkal is reagálnak, mint például a szénsav:
Az aminsók olyan szilárd anyagok, amelyek vízben jól és nem poláros szerves oldószerekben rosszul oldódnak. Az aminsók lúgokkal való kölcsönhatása szabad aminok felszabadulásához vezet, hasonlóan az ammónia kiszorulásához, amikor lúgok hatnak az ammóniumsókra:
2. Az elsődleges telített aminok salétromsavval reagálva megfelelő alkoholokat, nitrogén-N2-t és vizet képeznek. Például:
Ennek a reakciónak a jellegzetessége a nitrogéngáz képződése, ezért minőségi a primer aminokra, és arra szolgál, hogy megkülönböztesse őket a szekunder és tercier aminoktól. Meg kell jegyezni, hogy ezt a reakciót leggyakrabban úgy hajtják végre, hogy az amint nem magával a salétromsav-oldattal, hanem egy salétromsav-só (nitrit) oldatával keverik össze, majd ehhez a keverékhez erős ásványi savat adnak. Amikor a nitritek kölcsönhatásba lépnek erős ásványi savakkal, salétromsav képződik, amely azután reagál az aminnal:
A másodlagos aminok hasonló körülmények között olajos folyadékokat, úgynevezett N-nitrozaminokat adnak, de ez a reakció a kémia valódi USE tesztjeiben nem fordul elő. A tercier aminok nem lépnek reakcióba salétromsavval.
Az aminok teljes égése szén-dioxid, víz és nitrogén képződéséhez vezet:
Kölcsönhatás halogén-alkánokkal
Figyelemre méltó, hogy pontosan ugyanazt a sót kapjuk hidrogén-kloridnak egy jobban szubsztituált aminra való reagáltatásával. Esetünkben, amikor a hidrogén-klorid reakcióba lép dimetil-aminnal:
Aminok előállítása:
1) Ammónia alkilezése halogén-alkánokkal:
Ammóniahiány esetén amin helyett sóját nyerik:
2) Redukció fémekkel (az aktivitási sorozatban hidrogénné) savas környezetben:
majd az oldatot lúggal kezeljük a szabad amin felszabadítása érdekében:
3) Az ammónia reakciója alkoholokkal, amikor keveréküket hevített alumínium-oxidon vezetik át. Az alkohol/amin aránytól függően primer, szekunder vagy tercier aminok képződnek:
Az anilin kémiai tulajdonságai
Anilin - az aminobenzol triviális neve, amelynek képlete:
Amint az az ábrán látható, az anilinmolekulában az aminocsoport közvetlenül kapcsolódik az aromás gyűrűhöz. Az ilyen aminok, mint már említettük, sokkal kevésbé kifejezett bázikus tulajdonságokkal rendelkeznek, mint az ammónia. így különösen az anilin gyakorlatilag nem lép reakcióba vízzel és gyenge savakkal, például szénsavval.
Anilin reakciója savakkal
Az anilin erős és közepes erősségű szervetlen savakkal reagál. Ebben az esetben fenil-ammóniumsók képződnek:
Anilin reakciója halogénekkel
Ahogy már a fejezet elején elhangzott, az aromás aminokban lévő aminocsoport az aromás gyűrűbe húzódik, ami viszont csökkenti a nitrogénatomon az elektronsűrűséget, és ennek eredményeként növeli az aromás gyűrűben. Az aromás gyűrű elektronsűrűségének növekedése azt a tényt eredményezi, hogy az elektrofil szubsztitúciós reakciók, különösen a halogénekkel való reakciók sokkal könnyebben mennek végbe, különösen az aminocsoporthoz képest orto és para helyzetben. Így az anilin könnyen reagál brómos vízzel, fehér csapadékot képezve a 2,4,6-tribróm-anilinből:
Ez a reakció kvalitatív az anilin esetében, és gyakran lehetővé teszi más szerves vegyületek között történő azonosítását.
Anilin reakciója salétromsavval
Az anilin reagál a salétromsavval, de a reakció sajátossága és összetettsége miatt nem jelenik meg a valódi kémia egységes államvizsgán.
Anilin alkilezési reakciók
Az anilin nitrogénatomon halogénezett szénhidrogénekkel történő szekvenciális alkilezésével szekunder és tercier aminok állíthatók elő:
Az aminosavak kémiai tulajdonságai
Aminosavak olyan vegyületek, amelyek molekulái kétféle funkciós csoportot tartalmaznak - amino- (-NH 2) és karboxi- (-COOH) csoportokat.
Más szóval, az aminosavak karbonsavak származékainak tekinthetők, amelyek molekuláiban egy vagy több hidrogénatomot aminocsoportok helyettesítenek.
Így az aminosavak általános képlete felírható a következőképpen: (NH 2) x R(COOH) y, ahol x és y legtöbbször eggyel vagy kettővel egyenlő.
Mivel az aminosavmolekulák aminocsoportot és karboxilcsoportot is tartalmaznak, kémiai tulajdonságaik hasonlóak az aminokhoz és a karbonsavakhoz.
Az aminosavak savas tulajdonságai
Sók képzése lúgokkal és alkálifém-karbonátokkal
Aminosavak észterezése
Az aminosavak reagálhatnak alkoholokkal való észterezéssel:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Az aminosavak alapvető tulajdonságai
1. Sók képződése savakkal való kölcsönhatás során
NH 2 CH 2 COOH + HCl → + Cl —
2. Kölcsönhatás salétromsavval
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Megjegyzés: a salétromsavval való kölcsönhatás ugyanúgy megy végbe, mint a primer aminokkal
3. Alkilezés
NH 2 CH 2 COOH + CH 3 I → + I —
4. Aminosavak kölcsönhatása egymással
Az aminosavak egymással reakcióba lépve peptideket képezhetnek - olyan vegyületeket, amelyek molekuláiban a –C(O)-NH- peptidkötést tartalmazzák.
Ugyanakkor meg kell jegyezni, hogy két különböző aminosav reakciója esetén, bizonyos specifikus szintézisfeltételek betartása nélkül, különböző dipeptidek képződése egyidejűleg megy végbe. Így például a glicin és az alanin fenti reakciója helyett, amely glicilananinhoz vezet, egy olyan reakció léphet fel, amely alanilglicinhez vezet:
Ezenkívül a glicin molekula nem feltétlenül lép reakcióba az alanin molekulával. Peptizálási reakciók a glicinmolekulák között is előfordulnak:
És alanin:
Ezen túlmenően, mivel a keletkező peptidek molekulái az eredeti aminosavmolekulákhoz hasonlóan aminocsoportokat és karboxilcsoportokat tartalmaznak, a peptidek maguk is reakcióba léphetnek aminosavakkal és más peptidekkel az új peptidkötések kialakulása miatt.
Az egyes aminosavakat szintetikus polipeptidek vagy úgynevezett poliamid rostok előállítására használják. Így különösen a 6-aminohexán (ε-aminokapronsav) polikondenzációjával a nejlont az iparban szintetizálják:
A kapott nejlongyantát textilszálak és műanyagok előállítására használják.
Aminosavak belső sóinak képződése vizes oldatban
Vizes oldatokban az aminosavak túlnyomórészt belső sók - bipoláris ionok (ikerionok) formájában léteznek.
Bármely amin nitrogénatomján magányos elektronpár található. Amikor egy amin vízbe kerül, a vízből származó protonok donor-akceptor mechanizmuson keresztül új kovalens poláris kötést hozhatnak létre egy nitrogénatommal, ezáltal alkil- vagy aril-ammóniumiont hozva létre. A protont elvesztett víz hidroxidionná válik. A környezet lúgossá válik. Így az aminok bázisok. E bázisok erőssége a nitrogénhez kapcsolódó gyökök természetétől és számától függ. Az alifás gyökök, mint például a metil-, etil-, stb., amelyek elektronadó tulajdonságaikat mutatják, növelik az aminok bázikusságát. Az aromás gyökök éppen ellenkezőleg, a benzolgyűrűn lévő elektronpár delokalizációja miatt nagymértékben csökkentik a bázikusságot. Linus Pauling rezonanciaelméletét tekintve ez így néz ki:
Mint látható, a nitrogénatomon egy magányos elektronpár csak az egyik rezonanciaszerkezetben (mezomer formák) van jelen. A másik három bipoláris szerkezetben ezzel szemben a nitrogénatomon van egy „+” - egy töltés, amely természetesen megakadályozza a protonálódást. Ez az oka a bázikusság meredek csökkenésének. Elérhetőség in O-És P- A negatív töltések pozíciói lehetővé teszik számunkra, hogy feltételezzük az elektrofil szubsztitúciós reakciók könnyűségét pontosan ezekben a pozíciókban, ahol a támadó részecske egy kation (pl.
![]() ) Az alábbiakban példákat mutatunk be az ilyen típusú reakciókra aromás aminokkal.
) Az alábbiakban példákat mutatunk be az ilyen típusú reakciókra aromás aminokkal.
Kvantitatívan a bázisok erősségét K b értékekkel vagy azok negatív logaritmusával, pK b jellemezzük. A „b” index azt jelenti, hogy a bázis, amely egy amin, és a konjugált sav, azaz az ammóniumion közötti egyensúlyi állandóról beszélünk:
Definíció szerint egy ilyen reverzibilis reakciót a következő analitikai kifejezés írja le:

Mivel a híg vizes oldatokban a víz koncentrációja gyakorlatilag állandó és egyenlő 55,5 mol/l, akkor benne van az „új” egyensúlyi állandóban:

Az egyenlet jobb oldalának számlálóját és nevezőjét megszorozva [H + ]-vel, és figyelembe véve, hogy [H + ] [OH - ] = K w = 10 -14 kapjuk:

Ennek az analitikus kifejezésnek a logaritmizálása decimális logaritmusokkal,
egyenlethez jutunk:

Az előjeleket az ellenkezőjére változtatva és bevezetve az általánosan elfogadott jelölést: - lg = p, kapjuk:

Mivel az egység logaritmusa bármely bázisban egyenlő nullával, 14 pedig pH = pOH, nyilvánvaló, hogy pK b a hidroxil-ionok azon koncentrációjának az értékének felel meg, amelynél az ammónium-kationok fele elmegy egy bázis eltávolításával. proton szabad aminná. A bázisok pKa-értéke ugyanaz, mint a savak pKa-értéke. Az alábbiakban egy táblázat látható, amelynek adatai a gyökök természetének és mennyiségének hatását mutatják be a különböző aminok bázikussági állandóinak értékére.
| Alapnév | Alapképlet | Alaptípus | K b 25 o C-on | pK b értéke 25 o C-on |
| Ammónia | 1,75 10 -5 | 4,75 | ||
| Metilamin | Elsődleges alifás | 4,60 10 - 4 | 3,34 | |
| Etil-amin | | Elsődleges alifás | 6,50 10 - 4 | 3,19 |
| butil-amin | Elsődleges alifás | 4,00 10 - 4 | 3,40 | |
| izobutiamin | | Elsődleges alifás | 2,70 10 - 4 | 3,57 |
| Deut.-butil-amin | | Elsődleges alifás | 3,60 10 - 4 | 3,44 |
| Tret-butil-amin | Elsődleges alifás | 2,80 10 - 4 | 3,55 | |
| benzil-amin | | Elsődleges alifás | 2,10 10 -5 | 4,67 |
| Dimetil-amin | Másodlagos alifás | 5,40 10 -4 | 3,27 | |
| Dietilamin | Másodlagos alifás | 1,20 10 - 3 | 2,91 | |
| Trimetil-amin | Harmadlagos alifás | 6,50 10 -5 | 4,19 | |
| trietil-amin | | Harmadlagos alifás | 1,00 10 - 3 | 3,00 |
| Anilin | Elsődleges aroma. | 4,30 10 - 10 | 9,37 | |
| P-toluidin | | Elsődleges aroma. | 1,32 10 -9 | 8,88 |
| P-nitroanilin | | Elsődleges aroma. | 1,00 10 - 13 | 13,0 |
| N,N-dimetil-anilin | Harmadlagos zsíros aromás | 1,40 10 -9 | 8,85 | |
| Difenil-amin | Másodlagos aroma. | 6,20 10 -14 | 13,21 | |
| piridin | Heteroaromás | 1,50 10 - 9 | 8,82 | |
| kinolin | Heteroaromás | 8,70 10 -10 | 9,06 | |
| Piperidin | Másodlagos alifás és heterociklusos | 1,33 10 -3 | 3,88 | |
| Hidrazin | 9,30 10 -7 | 6,03 | ||
| Hidroxil-amin | 8,90 10 - 9 | 8,05 | ||
| Etanolamin | Prod. első alif. | 1,80 10 - 5 | 4,75 |
Ezek a táblázatok lehetővé teszik, hogy a következő következtetéseket vonjuk le:
1) Az alifás aminok sokkal erősebb bázisok, mint az aromás aminok (körülbelül 100 000-1 000 000-szer)
2) A heteroaromás aminok bázikussága közel áll az aromás aminokhoz.
3) Az aromás aminok bázikusságát erősen befolyásolják a bennük található szubsztituensek pár- pozíció az aminocsoporthoz. Az elektrondonor szubsztituensek növelik az amin bázikusságát, míg az elektronvonó szubsztituensek élesen csökkentik. A jelzett helyzetben metil- és nitrocsoportokat tartalmazó aromás aminok bázikussági aránya körülbelül 10 000:1.
4) A szekunder alifás aminok valamivel lúgosabbak, mint a primer aminok, míg a tercier alifás aminok azonos szintű bázikussággal rendelkeznek.
5) A primer aminokban lévő gyök természete nem befolyásolja jelentősen az amin bázikusságát.
6) A telített heterociklusos aminok bázisosak a szekunder alifás aminok szintjén.
7) A zsíros aromás aminok bázikussága az aromás aminok szintjén van.
8) A szekunder aromás aminok bázikussága körülbelül 10 000-szer kisebb, mint az elsődlegeseké.
9) A molekulában az aminocsoport nitrogénatomjához kötődő elektronegatív atomok 10-szeresére (nitrogén) és 1000-szeresére (oxigén) csökkentik a bázikusságát.
10) Az aminocsoporttól két metiléncsoporttal elválasztott oxigénatom mindössze 67-szeresére csökkenti a bázikusságát.
Azt is meg kell jegyezni, hogy a savamidok bázikussága a karbonilcsoport elektronszívó hatása miatt nagyon alacsony - még a szekunder aromás aminokénál is alacsonyabb: az acetamidnál pK b = 13,52; az acetanilidre pK b = 13,60 és a karbamidra pK b = 13,82
acetamid acetanilid karbamid
Mint az alapok primer, szekunder és tercier aminok reagál savakkal:
propil-amin propilammónium-bromid
dimetil-amin dimetilammónium-szulfát
trimetil-amin trimetilammónium-perklorát
Többbázisú savakkal nemcsak átlagok képezhetők, hanem és savas sók:
dimetil-amin dimetil-ammónium-hidrogén-szulfát
metil-izobutil-amin metil-izobutil-ammónium-dihidrogén-ortofoszfát
Elsődleges aromás anyagok, és szekunder és tercier zsíros aromás aminok erős savak híg vizes oldataival is adnak só:


Képesek alakítani is só Befolyása alatt koncentrált erős savak, de at vízzel hígítva ezek a sók hidrolizálni, gyenge alapot adva, vagyis szülő amin:

Mint nagyon gyenge alapok, ne adj sókat sem tömény sósavval, sem kénsavval. Igaz, a trifenil-amin még mindig perklorátot termel perklórsavval:

.
Elsődleges alifás aminok két szakaszban reagálnak: az elsőben rendkívül instabil vízben még lehűtve is diazónium só, amely a második szakaszban vízzel reagálva képződik alkohol:
propil-amin-propil-diazónium-klorid
propanol-1
Egy primer amin reakciójában nátrium-nitrittel és sósavval, gázfejlődés(jól láthatók a buborékok) és halszagú amin változások az alkoholhoz minőségi reakció egy primer alifás aminra.
Ha összeadjuk a fenti két reakciót, akkor a következőt kapjuk:
Másodlagos aminok teljesen másképpen reagálnak: nátrium-nitrit és sósav hatására, N-nitrozamin- nagyon stabil csatlakozás még fűtött állapotban is:
metil-etil-amin N-nitrozometiletiamin
Egy szekunder alifás amin reakciójában nátrium-nitrittel és sósavval, vízben rosszul oldódó és rendkívül kellemetlen szagú sárga olaj képződése egy minőségi reakció egy szekunder alifás aminra.
Nitrózaminok - rákkeltő anyagok: a kísérleti állat szervezetébe jutás helyétől és módjától függetlenül májrákot okoznak. Széles körben használják a kísérleti onkológiában. Felszívódóan hatnak, vagyis a bőrön keresztül.
Tercier alifás aminok nátrium-nitrit és sósav keverékéből reagál csak savval:
Ebben a reakcióban nincsenek látható hatások. A szag gyengül.
Elsődleges aromás aminok 0 és 5 o C közötti hőmérsékleten viszonylag stabilan reagálnak diazóniumsók. Ezt a reakciót először 1858-ban publikálta egy német kémiai folyóiratban Peter Griess, és az ő nevét viseli:
A Griess-reakció számos anilinhomológot tartalmaz, amelyek alkil-szubsztituenst tartalmaznak o-,m- És P- pozíció az aminocsoporthoz:
Ide tartoznak az elektronvonó, elektrondonor szubsztituenseket és egy speciális csoportba tartozó szubsztituenseket tartalmazó anilinszármazékok is, például:
A hidrogén-bromiddal a reakció gyorsabb, de ritkán használják, és csak laboratóriumban használják a sav magas költsége és szűkössége miatt.
A diazóniumsók előállítása során azonnal felhasználják őket a szintézis következő szakaszaiban, de a laboratóriumban gyakran izolálják őket telített nátrium-tetrafluor-borát-oldattal végzett cserereakcióval:

A diazóniumsókat leggyakrabban számos azofesték előállítására használják fenolokkal (naftolokkal) és aromás tercier aminokkal történő azokapcsolással, például:


A keletkező azofesték pH-indikátor: savas környezetben a hidrogénkötés kialakulása miatt lapos szerkezetű, amelyben a hidroxilcsoport elektrondonor hatása gyengül - ezt a formát sárgára színezzük. A lúgos csoportban egy protont eltávolítanak a hidroxilcsoportból, megjelenik egy „fenolát ion”, amely a legerősebb ED szubsztituens, és a színe vörös-narancssárgára változik:

A szóda szerepe az azo-kapcsolási reakcióban a keletkező sósav (vagy más erős) sav sóvá - nátrium-hidrogén-karbonáttá - megkötése:
A nátrium-karbonát és a nátrium-hidrogén-karbonát keveréke pufferoldat, amely enyhén lúgos környezetet hoz létre.
A tercier aromás aminoknál az azo-kapcsolásnak enyhén savas környezetben kell végbemennie, amit az anionon hidrolizáló sók, például nátrium-acetát hozzáadásával biztosítanak. Erősen savas környezetben az amin ammóniumsót képez, amelynek kationja természetesen nem lép reakcióba a diazónium kationnal.


A nátrium-acetát azonnal reagál a keletkező sósavval. Az eredmény egy pufferoldat, amely gyenge ecetsavból és feleslegben lévő nátrium-acetátból áll. Enyhén savas környezetet biztosít:
Másodlagos aromás aminok reagál nátrium-nitrittel és sósavval oktatással N-nitrozaminok. Például az N-metil-anilin N-nitrozo-N-metilanilint ad, egy rendkívül kellemetlen szagú sárga olajat, amely 13 °C-on megkeményedik:
Az aromás N-nitrozoaminok az alifás aminokhoz hasonlóan rákkeltő anyagok. Májrákot is okoznak, és kísérleti onkológiában is alkalmazzák.
Az aromás N-nitrozoaminok száraz hidrogén-klór- vagy bromid hatására vagy tömény kénsav hatására átrendeződésen mennek keresztül, amelyet először 1886-ban publikáltak egy német kémiai folyóiratban O. Fischer és E. Hepp. Ilyen körülmények között a nitrozocsoport szelektíven átkerül P-pozíció:
Az átrendeződés eredményeként kapott 4-nitrozo-N-metil-anilin teljesen eltérő fizikai tulajdonságokkal és biológiai aktivitással rendelkezik. Ez egy zöld szilárd anyag, olvadáspontja 113 °C. Szerves oldószerekben fluoreszkál. Nem rákkeltő, bár dermatitiszt okoz.
Tercier aromás aminok reagál nátrium-nitrittel és sósavval, Adni C-nitrozovegyületek. A nitrozocsoport szelektíven irányul P-pozíció:
A C-nitrozovegyületek könnyen redukálhatók hidrogénnel Raney-nikkelen. Ez aszimmetrikus dialkil-diaminokat eredményez, például:
Az alifás és aromás aminok sói lúgok hatására könnyen visszaalakulhatnak aminokká, pl.
propil-ammónium-perklorát propil-amin
metilpropil-ammónium-hidrogén-szulfát metilpropil-amin

kvaterner ammónium bázisok, ellenkezőleg, lefordítható kvaterner ammóniumsók akció savak:
Dimetil-etil-izopropil-ammónium-hidroxid-dimetil-etil-izopropil-ammónium-klorid
Amint láthatja, ez egy gyakori reakció, amikor egy lúgot semlegesítenek egy savval - sót és vizet kapnak.
A kézikönyv 19. oldalán azt javasolták, hogy az elektrofil szubsztitúciós reakciók könnyen mennek végbe aromás aminokban orto- És pár- a benzolgyűrű helyzete. Valójában az anilin könnyen brómozható az összes ilyen helyzetben egyszerre:

Az N,N-dialkil-anilineket szulfonálják, nitrálják és diazotizálják orto- És pár- pozíciók:




A nátrium-acetát az erős komplex savat gyenge savvá alakítja: ecetsav:
Aminok alkalmazása
A legegyszerűbb primer amin az metil-amin inszekticidek, gombaölők, vulkanizálást gyorsító szerek, felületaktív anyagok, gyógyszerek, színezékek, rakéta-üzemanyagok és oldószerek szintézisében használják. Például az N-metil-2-pirrolidont, amely a lakkok és bizonyos színezékek népszerű oldószere, metil-amint γ-butirolaktonnal (a 4-hidroxi-butánsav gyűrűs észterével) reagáltatva állítják elő:

y-butirolát N-metil-2-pirrolidon
A legegyszerűbb másodlagos amin az dimetil-amin inszekticidek, gyomirtó szerek, vulkanizálást gyorsító szerek, felületaktív anyagok, számos gyógyszer, színezék és olyan fontos oldószerek szintézisében használják, mint a dimetil-foriamid (DMF), a dimetil-acetamid (DMAA) és a hexametil-foszfortriamid (HMPTA) vagy a hexametapol. A DMF-et iparilag állítják elő, például dimetil-amint hangyasav-metil-észterrel reagáltatva:
metil-formiát dimetil-amin DMF metanol
A DMAA-t iparilag állítják elő, dimetil-amint ecetsavanhidriddel reagáltatva:
DMAA ecetsavanhidrid
A hexametapol ipari szintézise magában foglalja a dimetil-amin és a foszfor-oxi-klorid kölcsönhatását:

foszfor-triklorid HMPTA
A legegyszerűbb tercier amin az trimetil-amin kvaterner ammóniumbázisok, flotációs szerek, retardánsok, takarmány-adalékanyagok szintézisében használják. Például a glaukóma és a belek vagy a hólyag posztoperatív atóniájának kezelésére használt karbakolin szintézisének utolsó szakasza a trimetil-amin és az etilén-klórhidrin karbamoil-származékának kölcsönhatását foglalja magában:
karbakolin
A kationos felületaktív anyagokat hasonló módon állítják elő:
trimetil-alkil-ammónium-klorid
Etil-amin festékek, felületaktív anyagok, gyomirtó szerek előállításához használják. Például a simazint, a kukorica és a zöldségek gyomok elleni védelmére szolgáló herbicidet úgy állítják elő, hogy etil-amint reagáltatnak a számított mennyiségű cianur-kloriddal lúgos közegben:
klórcianur szimazin
Dietilamin festékek, peszticidek, gumi vulkanizálást gyorsítók, korróziógátlók, gyógyszerek és repellensek előállításához használják. Például a jól ismert DEET szúnyogriasztót a következő reakcióval kapják:

savklorid m-tolusav N,N-dietil- m-toluamid
izopropil-amin, butil-amin, izobutil-amin, kedd-butiamin és tert- butil-aminok hasonló iparágakban használják.
1,6-hexán-diamin széles körben használják nejlon szintézisére 1,4-bután-dikarbonsavval (adipinsavval) végzett polikondenzációs reakcióval:

A gyógyszerek közül sok különböző típusú aminocsoportokat tartalmaz. Így például az M.D. referenciakönyvében felsorolt 1308 gyógyszer közül. Mashkovsky szerint legalább 70 primer amin, legalább 52 szekunder és legalább 108 tercier amin. Ezenkívül a gyógyszerek között található 41 kvaterner ammóniumsó és több mint 70 karbonsavamid, 26 arilszulfonsav-amid és 12 ortofoszforsav-származék amidja. Vannak ciklikus amidok - laktámok is. 5 név van. Természetes aminosavak származékai – 14 név. Az alábbiakban példák találhatók a felsorolt funkcionális csoportokat tartalmazó gyógyszerekre:
Anestezin– etil-éter P-aminobenzoesav. Ez egy elsődleges aromás amin és egy észter egyszerre.

Helyi érzéstelenítő hatása van. Sebek és fekélyek fájdalmának enyhítésére, terhesség alatti hányás, tengeri és légi betegségek esetén alkalmazzák.
Baclofen– 4-amino-3-( P-klór)-fenil-butánsav. Ez egy elsődleges alifás amin, egy észter és egy halogén származék a benzol sorozatból egyszerre.

Csökkenti az izomfeszültséget és fájdalomcsillapító hatású. Sclerosis multiplexben alkalmazzák.
Salbutamol – 2-dörzsöli-butil-amino-1-(4"-hidroxi-3"-hidroxi-metil)-fenil-etanol. Másodlagos alifás amin, szekunder és primer alkoholok és fenol egyszerre.

Hörgőtágító hatása van, és terhes nőknél megelőzi a korai összehúzódásokat. Asztma bronchiális kezelésére és a szülészeti gyakorlatban alkalmazzák.
Ortofen– 2-(2",6"-diklór)fenilamino-fenil-ecetsav nátriumsója. Ez egy szekunder aromás amin, egy karbonsav sója és egy benzolsorozat halogénszármazéka egyszerre.

Gyulladáscsökkentő, fájdalomcsillapító és lázcsillapító hatása van. Akut reuma, rheumatoid arthritis, spondylitis ankylopoetica, arthrosis, spondyloarthrosis kezelésére használják.
Isoverine– N-izoamil-1,5-pentándiamin-dihidroklorid. Ez egyidejűleg primer és szekunder aminok diammóniumsója.

Csökkenti a vérnyomást, növeli a tónust és fokozza a méhizmok összehúzódását. Szülésgyorsítóként és a szülés utáni időszakban a méhösszehúzódások serkentésére használják.
Metilénkék– N,N,N’,N’-tetrametiltionin-klorid. Ez egyszerre egy tercier zsír aromás amin és egy ammóniumsója ugyanannak az aminnak. Ezenkívül tartalmaz egy heteroaromás gyűrűt „piridin” nitrogénatommal.

Külsőleg fertőtlenítőszerként használják égési sérülések, pyoderma és folliculitis esetén. Hólyaghurut és urethritis esetén az üregeket 0,02%-os kék oldattal mossuk.
Pentamin– 3-metil-1,5-bisz-(N,N-dimetil-N-etil)ammónium-3-azapentán-dibromid. Ez egyszerre tercier alifás amin és ugyanazon aminok kétszeresen kvaterner ammóniumsója.

Ganglionblokkoló aktivitással rendelkezik. Hipertóniás krízisek, perifériás erek görcsei, bél- és epeúti görcsök, vesekólikák, bronchiális asztma akut rohamainak enyhítésére, valamint tüdő- és agyödéma kezelésére használják.
Nikotinamid– 3-piridinkarbonsavamid. Ez egy karbonsavamid és a nitrogéntartalmú heteroaromás gyűrű, a piridin származéka.

Pellagikus hatású, javítja a szénhidrát-anyagcserét, pozitív hatással van a cukorbetegség enyhe formáira, máj- és szívbetegségekre, gyomor- és nyombélfekélyre. Alacsony savasságú gyomorhurut, akut és krónikus hepatitis, cirrhosis, végtagok, vesék és agyi érgörcsök esetén alkalmazzák.
Szulfadimezin – 2-(P- amino-benzolszulfamido)-4,6-dimetil-pirimidin. A szulfonamid gyógyszerek nagy csoportjának képviselője. Egyszerre szulfanilamid, primer aromás amin és a nitrogéntartalmú heteroaromás gyűrű – a pirimidin – származéka.

Mint minden ebbe a csoportba tartozó gyógyszer, a szulfadimezin is aktív antimikrobiális szer. Pneumococcus, streptococcus, meningococcus fertőzések, szepszis, gonorrhoea, valamint E. coli és más mikrobák okozta fertőzések esetén alkalmazzák.
Fopurin – 6-dietilénamidofoszfamido-2-dimetil-amino-7-metil-purin. Ez egyidejűleg egy hármas foszfamid, egy tercier aromás amin és egy nitrogéntartalmú heteroaromás bicikli származéka - purin
Hemodez– kis molekulatömegű polivinil-pirrolidon 6%-os víz-só oldata. A polimer elemi egysége laktámgyűrűt tartalmaz.

Megköti a vérben keringő méreganyagokat, és gyorsan eltávolítja azokat a vesegáton keresztül. Dizentéria, dyspepsia, szalmonellózis és mérgezési szakaszban előforduló égési betegségek kezelésére használják.
hisztidin– L-β-imidazolilalanin vagy L-α-amino-β-(4-imidazolil)propionsav. Ez egy α-aminosav és a nitrogéntartalmú heteroaromás gyűrű, az imidazol származéka.

A hisztidin esszenciális aminosav; Különböző szervekben megtalálható, része a karnozinnak, egy nitrogéntartalmú kivonó anyagnak az izmokban. A szervezetben dekarboxiláción megy keresztül, hisztamin képződésével, amely az életfunkciók szabályozásában szerepet játszó egyik kémiai tényező (közvetítő).
Angiotenzinamid– L-aszparaginil-L-arginil-L-valil-L-tirozinil-L-valil-L-hisztidinil-acetát – L-prolil-L-fenilalanin. Ez egy természetes α-aminosavakból álló oktapeptid ecetsav sója.

Sokkos körülmények között a belső szervek, a bőr és a vesék vérereinek gyors és erős összehúzására használják. Az angiotenzinamid emellett képes összehúzni a méh, a belek, a hólyag és az epehólyag simaizmait. Serkenti az adrenalin felszabadulását a mellékvesékből és az aldoszteron termelődését.
| Aminok. Meghatározás | |
| Az aminok osztályozása a gyökökkel helyettesített ammóniában lévő hidrogénatomok száma szerint | |
| Az aminok osztályozása a nitrogénatomhoz kapcsolódó gyökök természete szerint | |
| Az alifás aminok izomerizmusa és nómenklatúrája | |
| Módszerek aminok előállítására | |
| Aminok előállítása egyéb nitrogéntartalmú vegyületekből | |
| Nitrovegyületekből | |
| Nitrozovegyületekből | |
| Az oximokból | |
| Hidrazonokból | |
| Karbonsavak amidjaiból | |
| Karbonsav-nitrilekből: 7 | |
| Aminok előállítása más osztályokba tartozó vegyületekből | |
| Aldehidekből és ketonokból Leuckart-Wallach reakcióval | |
| Primer alifás aminok előállítása ammónia-alkilezéssel | |
| Másodlagos alifás aminok előállítása primer aminok alkilezésével | |
| Tercier alifás aminok előállítása szekunder aminok alkilezésével | |
| Kvaterner ammóniumsók előállítása tercier aminokból | |
| Kvaterner ammóniumbázisok előállítása kvaterner ammóniumsókból | |
| Kvaterner ammóniumbázisok termolízise | |
| Primer aromás aminok alkilezése szimmetrikussá | |
| tercier aminok | |
| Másodlagos zsíros aromás aminok négylépéses szintézise | |
| Tiszta primer aminok előállítása Gabriel szerint | |
| Aminok előállítása alkoholokból | |
| Aromás aminok előállítása | |
| Aromás nitrovegyületek redukciója az N.N. Zinina | |
| Aromás nitrovegyületek redukciója Bechamp szerint | |
| Aromás nitrovegyületek katalitikus redukciója hidrogénnel | |
| Az alifás aminok fizikai tulajdonságai | |
| Az alifás aminok fizikai állapota | |
| Az alifás aminok forráspontjának függése a szerkezettől | |
| Az alifás aminok oldhatósága vízben és szerves oldószerekben | |
| Az aromás aminok fizikai tulajdonságai | |
| Aromás aminok fizikai állapota és oldhatósága | |
| Az aminok kémiai tulajdonságai | |
| Az aminok elektronszerkezete és a bázikusság kapcsolata | |
| Alifás, aromás és heterociklusos aminok és néhány rokon vegyület bázikussági állandói és pKb értékei | |
| Aminok reakciói savakkal | |
| Aminok kölcsönhatása nátrium-nitrittel és sósavval | |
| Primer alifás aminok átalakítása alkoholokká diazovegyületeken keresztül | |
| Másodlagos alifás aminok átalakítása N-nitrozovegyületekké | |
| Az alifás N-nitrozaminok rákkeltő hatása | |
| Tercier alifás aminok kölcsönhatása nátrium-nitrittel | |
| és sósav | |
| Primer aromás aminok átalakítása diazóniumsókká | |
| Diazóniumsók izolálása oldatokból tetrafluorborátok formájában | |
| Azóz kapcsolási reakció fenolokkal (naftolokkal) | |
| Azofestékek pH indikátorként | |
| Azo-kapcsolási reakció tercier aromás aminokkal | |
| Másodlagos zsíros aromás aminok átalakítása N-nitrozaminokká | |
| A zsíros-aromás N-nitrozaminok rákkeltő hatása | |
| Fischer-Hepp átrendeződés | |
| A tercier aromás aminok átalakítása C-nitrozovegyületekké | |
| Aromás C-nitrozovegyületek katalitikus redukciója hidrogénnel | |
| Alifás és aromás aminok sóinak kölcsönhatása lúgokkal | |
| Kvaterner ammóniumbázisok kölcsönhatása savakkal | |
| Elektrofil szubsztitúciós reakciók aromás aminokban | |
| Aminok alkalmazása | |
| Metil- és dimetil-aminok alkalmazása | |
| Népszerű szerves oldószerek előállítása: DMF, DMAA és HMPTA | |
| Trimetil- és etil-aminok alkalmazása | |
| Dietilamin alkalmazása | |
| Diaminok alkalmazása poliamid polimerek előállítására | |
| Gyógyszerek – aminok és aminszármazékok | |
| Anestezin | |
| Baclofen | |
| Salbutamol | |
| Ortofen | |
| Isoverine | |
| Metilénkék | |
| Pentamin | |
| Nikotinamid | |
| Szulfadimezin | |
| Fopurine | |
| Hemodez | |
| hisztidin | |
| Angiotenzinamid | |
| Tartalom |
Az aminok a szerves vegyületek egyetlen osztálya, amely észrevehetően bázikus. Az aminok azonban gyenge bázisok. Most hasznos lesz visszatérni az asztalhoz. 12-1, hogy felidézzük a savak és bázisok három definícióját. A bázikusság három definíciója szerint az aminok kémiai viselkedésének három aspektusa különböztethető meg.
1. Az aminok reakcióba lépnek savakkal, proton akceptorként működnek:
Ezért az aminok Bronsted-bázisok. 2. Az aminok elektronpár donorok (Lewis-bázisok):

3. Az aminok vizes oldataiban tehát az aminok vízzel kölcsönhatásba lépve hidroxid-anionokat képesek létrehozni.

Ezért az aminok Arrhenius-bázisok. Bár minden amin gyenge bázis, bázikusságuk a nitrogénatomhoz kapcsolódó szénhidrogén gyökök természetétől és számától függ. Az alkil-aminok sokkal bázikusabbak, mint az aromás aminok. Az alkil-aminok közül a legbázikusabbak a szekunderek, a primerek valamivel kevésbé bázikusak, ezt követik a tercier aminok és az ammónia. Általában az alaposság a következő sorrendben csökken:
Egy anyag bázikusságának mértéke a bázikussági állandó, amely egy amin és a víz kölcsönhatásának egyensúlyi állandója (lásd fent a bázikusság Arrhenius-definícióját). Mivel a víz nagy feleslegben van jelen, koncentrációja nem jelenik meg a bázikussági állandó kifejezésében:

Minél erősebb a bázis, annál több protont távolítanak el a vízmolekulákból, és annál nagyobb a hidroxidionok koncentrációja az oldatban. Így erősebb bázisok jellemezhetők
A nagy K-értékek egyes aminokra vonatkozó értékeket az alábbiakban adjuk meg:

Ezek az értékek illusztrálják az aminok bázikussága és szerkezetük közötti kapcsolatot, amelyet fentebb tárgyaltunk. A legerősebb bázis a szekunder dimetil-amin, a leggyengébb pedig az aromás amin-anilin.
Az aromás aminok nagyon gyenge bázisok, mert a nitrogénatom magányos elektronpárja (amely meghatározza az aminok alapvető tulajdonságait) kölcsönhatásba lép az aromás atommag -elektronfelhőjével, ezért kevésbé hozzáférhető a proton (vagy más sav) számára. A szekunder aminok primer aminokhoz képest nagyobb bázikusságát az magyarázza, hogy az alkilcsoportok pozitív induktív hatásuk miatt -kötéseken keresztül elektronokat szállítanak a nitrogénatomhoz, ami megkönnyíti az egyedüli elektronpár megosztását. Két alkilcsoport egynél több elektront ad a nitrogénatomhoz, így a szekunder aminok erősebb bázisok. Ez alapján azt várnánk, hogy a tercier aminok még erősebb bázisok, mint a szekunder aminok. Ez a feltételezés azonban csak a gázfázis esetében indokolt, és vizes oldatban a tercier aminok bázikussága nem olyan magas. Ez valószínűleg a szolvációs hatásoknak köszönhető.
Az aminok gyenge szerves bázisok. Bázikusságukat a nitrogénatomhoz kapcsolódó szerves szubsztituensek száma és jellege határozza meg. Az aromás gyűrű jelenléte erősen csökkenti a bázikusságot (aminok értéke. A szekunder aminok erősebb bázisok, mint a primer és tercierek.
Az aminok teljesen váratlanul jöttek az életünkbe. Egészen a közelmúltig ezek mérgező anyagok voltak, amelyekkel való ütközés akár halálhoz is vezethet. És most, másfél évszázaddal később aktívan használunk szintetikus szálakat, szöveteket, építőanyagokat és aminoalapú festékeket. Nem, nem lettek biztonságosabbak, az emberek egyszerűen képesek voltak „megszelídíteni” és leigázni őket, bizonyos előnyöket szerezve maguknak. Hogy melyiket, azt még megbeszéljük.
Meghatározás
Az oldatokban vagy vegyületekben lévő anilin kvalitatív és kvantitatív meghatározására olyan reakciót alkalmaznak, amelynek végén fehér csapadék 2,4,6-tribróm-anilin formájában esik a kémcső aljára.
Aminok a természetben
Az aminok a természetben mindenhol megtalálhatók vitaminok, hormonok és köztes anyagcseretermékek formájában, mind az állatok szervezetében, mind a növényekben. Emellett az élő szervezetek bomlása során közepes aminok is keletkeznek, amelyek folyékony halmazállapotban kellemetlen szagú heringsóoldatot bocsátanak ki. A szakirodalomban széles körben leírt „hullató méreg” pontosan az aminok sajátos borostyánjának köszönhetően jelent meg.
Az általunk vizsgált anyagokat sokáig összetévesztették az ammóniával, hasonló szaguk miatt. De a tizenkilencedik század közepén a francia kémikus, Wurtz képes volt metil-amint és etil-amint szintetizálni, és bebizonyítani, hogy égéskor szénhidrogének szabadulnak fel. Ez volt az alapvető különbség az említett vegyületek és az ammónia között.
Aminok előállítása ipari körülmények között
Mivel az aminokban a nitrogénatom a legalacsonyabb oxidációs állapotban van, a nitrogéntartalmú vegyületek redukciója a legegyszerűbb és legkönnyebben hozzáférhető módja ezek előállításának. Ezt a típust széles körben használják az ipari gyakorlatban alacsony költsége miatt.
Az első módszer a nitrovegyületek redukciója. Az anilin keletkezésének reakcióját Zinin tudós nevezte el, és először a tizenkilencedik század közepén hajtották végre. A második módszer az amidok redukálása lítium-alumínium-hidriddel. A primer aminok nitrilekből is kinyerhetők. A harmadik lehetőség az alkilezési reakciók, vagyis az alkilcsoportok bevitele ammónia molekulákba.
Aminok alkalmazása

Önmagukban, tiszta anyagok formájában, az aminokat ritkán használják. Az egyik ritka példa a polietilén-poliamin (PEPA), amely hazai körülmények között elősegíti az epoxigyanta keményedését. Alapvetően a primer, tercier vagy szekunder aminok különböző szerves anyagok előállításának közbenső termékei. A legnépszerűbb az anilin. Ez az alapja az anilinfestékek nagy palettájának. A végül kapott szín közvetlenül a kiválasztott alapanyagtól függ. A tiszta anilin kék színt ad, de az anilin, az orto- és para-toluidin keveréke vörös lesz.
Alifás aminokra van szükség poliamidok, például nylon és mások előállításához. Ezeket a gépészetben, valamint kötelek, szövetek és fóliák gyártásához használják. Ezenkívül alifás diizocianátokat használnak a poliuretánok gyártása során. Kivételes tulajdonságaik (könnyűség, szilárdság, rugalmasság és bármilyen felülethez való tapadhatóság) miatt keresettek az építőiparban (hab, ragasztó) és a cipőiparban (csúszásgátló talpak).
Az orvostudomány egy másik terület, ahol az aminokat használják. A kémia segít a szulfonamid-csoportból származó antibiotikumok szintetizálásában belőlük, amelyeket sikeresen használnak második vonalbeli gyógyszerként, azaz tartalékként. Abban az esetben, ha a baktériumok rezisztenciát alakítanak ki az alapvető gyógyszerekkel szemben.
Káros hatások az emberi szervezetre
Ismeretes, hogy az aminok nagyon mérgező anyagok. A velük való bármilyen kölcsönhatás egészségkárosodást okozhat: gőzök belélegzése, nyílt bőrrel való érintkezés vagy vegyületek szervezetbe jutása. A halál oxigénhiány miatt következik be, mivel az aminok (különösen az anilin) a vérben lévő hemoglobinhoz kötődnek, és megakadályozzák az oxigénmolekulák felszívódását. Riasztó tünetek a légszomj, a nasolabialis háromszög és az ujjbegyek kék elszíneződése, tachypnea (gyors légzés), tachycardia, eszméletvesztés.
Ha ezek az anyagok a test csupasz területeire kerülnek, gyorsan el kell távolítani őket alkohollal átitatott vattával. Ezt a lehető leggondosabban kell megtenni, hogy ne növelje a szennyeződés területét. Ha mérgezési tünetek jelentkeznek, feltétlenül forduljon orvoshoz.
Az alifás aminok mérgek az idegrendszerre és a szív- és érrendszerre. Májfunkció depressziót, májdisztrófiát és még húgyhólyagrákot is okozhatnak.