Amines
Klasifikácia a nomenklatúra
Amíny sú organické deriváty amoniaku, v molekule ktorých je jeden, dva alebo tri atómy vodíka nahradené radikálmi. Na tomto základe rozlišujú primárny (RNH 2), sekundárne (R2NH) a terciárne (R 3 N) amíny
V závislosti od povahy radikálu môžu byť amíny nasýtené alebo aromatické, ako aj nasýtené aromatické (metylamín, anilín a metylanilín). Rozvetvený radikál môže byť tiež spojený s atómom dusíka (napr. drhne butylamín) a polykondenzovaný, ako ukazuje príklad adamantylamínu (aminoadamantán), ktorý má biologický účinok a používa sa v medicíne


Podľa zásad racionálnej nomenklatúry názov tejto triedy látok pozostáva z názvu radikálov na atóme dusíka, tzv. amín. V názvoch primárnych amínov podľa medzinárodného názvoslovia je atóm dusíka amínu uvedený ako názov ami-Ale, používa sa uvedením jeho polohy pred názvom uhľovodíkového reťazca. Mnohé amíny si však zachovali svoje triviálne názvy, napr. anilín“.
Okrem aminoskupiny môžu molekuly organických látok obsahovať ďalšie substituenty, ako je to napríklad v prípade kyseliny sulfanilovej. V nasýtenom kruhu môže byť tiež zahrnutý amínový dusíkový atóm. Medzi nasýtenými heterocyklickými amínmi je trojčlenná štruktúra vybudovaná napätím etylénimín, so silným mutagénnym účinkom. Etylénimínový kruh je súčasťou molekúl niektorých liekov. Tetrahydropyrolové a piperidínové kruhy prítomné v molekulách mnohých alkaloidov (vrátane nikotínu a anabazínu, pozri časť 20.4) sú konštruované bez napätia. S ich účasťou, ako aj pomocou morfolínového kruhu sa budujú molekuly mnohých liekov.




Heterocyklické aromatické amíny sú napríklad pyrol a pyridín. Nakoniec, aminoskupina môže byť tiež spojená s heterocyklom, ako je znázornené na príklade adenínu (6-aminopurínu), esenciálneho fragmentu nukleových kyselín.


Deriváty amoniaku zahŕňajú aj organické látky, ktoré možno skonštruovať z amónnych solí alebo ich hydroxidov nahradením všetkých štyroch atómov vodíka rôznymi uhľovodíkovými radikálmi, ako je možné vidieť na príklade hydroxidu tetrametylamónneho:

Ďalším príkladom tetrasubstituovaných amóniových derivátov - kvartérnych amóniových báz alebo ich solí - je neurín, toxická látka vznikajúca pri rozklade živočíšneho tkaniva.
Kvartérny atóm dusíka môže byť súčasťou heterocyklov, napríklad zodpovedajúca soľ z pyridínovej série - N-alkylpyridíniová soľ. Takéto kvartérne soli zahŕňajú niektoré alkaloidy. Okrem toho sa kvartérny atóm dusíka nachádza v mnohých liečivých látkach a niektorých biomolekulách.
Vyššie uvedené príklady demonštrujú rozmanitosť aminozlúčenín a ich veľký medicínsky a biologický význam. K tomu je potrebné dodať, že aminoskupina je súčasťou takých tried biomolekúl, ako sú aminokyseliny a proteíny, nukleové kyseliny a je prítomná v množstve prírodných sacharidových derivátov nazývaných aminocukry. Aminoskupina je najdôležitejšou funkčnou skupinou alkaloidov a mnohých liečiv na rôzne účely. Niektoré príklady takýchto látok budú uvedené nižšie.
24.3.2. Amíny ako organické zásady

 Prítomnosť voľného elektrónového páru dusíka dáva amínom vlastnosti zásad. Charakteristickým znakom amínov je preto reakcia s kyselinami za vzniku zodpovedajúcich amónnych solí, ako je možné vidieť z reakcie pre primárny nasýtený amín:
Prítomnosť voľného elektrónového páru dusíka dáva amínom vlastnosti zásad. Charakteristickým znakom amínov je preto reakcia s kyselinami za vzniku zodpovedajúcich amónnych solí, ako je možné vidieť z reakcie pre primárny nasýtený amín:
Podobne anilínová soľ vzniká z anilínu, pyridíniová soľ vzniká z pyridínu atď. Podobne ako amoniak, amíny vo vodných roztokoch vytvárajú alkalické prostredie podľa rovnice:
Kvantitatívne sa zásaditosť zásad obsahujúcich dusík vo vodnom prostredí odráža v hodnote rovnovážnej konštanty (TO b ) (častejšie používajú hodnotu rK b ) yl/С а (ВН +), charakterizujúce kyslosť konjugovanej kyseliny danej zásady.

Najsilnejšie bázy budú zlúčeniny obsahujúce atóm dusíka, v ktorých sa osamotený pár dusíka nachádza v osamelom hybridnom orbitáli 5p 3 (alifatické amíny, amoniak, aminokyseliny), a najslabšie budú tie, v ktorých je tento pár zapojený do p. ,n konjugácia (amidy, pyrol, pyridín).
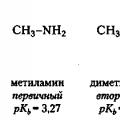
Substituenty poskytujúce elektróny, ktoré zahŕňajú alkylové skupiny, by mali zvýšiť zásaditosť amínov, pretože zvyšujú hustotu elektrónov na atóme dusíka. Áno, metylamín (pK b = 3.27) je silnejšia zásada ako amoniak (pK b = 4,75) a dimetylamín (pK b = 3.02) je silnejšia zásada ako metylamín. Avšak pri prechode na trimetylamín, na rozdiel od očakávania, zásaditosť mierne klesá (pK b = 4,10). Dôvodom je to, že so zvyšujúcim sa počtom substituentov na atóme dusíka sa prístup protónu stáva čoraz ťažším. Nehovoríme tu teda o elektrónovom, ale o priestorovom vplyve substituentov. Tento účinok substituentov sa nazýva stérický faktor.
Aromatické amíny sú slabšie zásady ako nasýtené v dôsledku účinku aromatického kruhu, ktorý odoberá elektróny. Preto je tiež nízka zásaditosť pyridínu. Akumulácia fenylových substituentov výrazne potláča aktivitu elektrónového páru atómu dusíka. takže, rK, difenylamín je 13,12 a trifenylamín vôbec nevykazuje vlastnosti zásady.
Extrémne nízka zásaditosť pyrolu je spôsobená tým, že v jeho molekule sa elektrónový pár atómu dusíka podieľa na tvorbe aromatickej väzby b-elektrónu. Jeho väzba s protónom si vyžaduje značný dodatočný výdaj energie. V dôsledku tvorby pyroliových solí mizne aromatická väzba a tým aj stabilita molekuly. To vysvetľuje skutočnosť, že pyrol sa v kyslom prostredí rýchlo stáva živicovým.
Je zaujímavé poznamenať, že silný účinok pyrolového kruhu na atóm dusíka, ktorý priťahuje elektróny, vedie k oslabeniu väzby N-H, vďaka čomu je pyrol schopný vykazovať vlastnosti slabej kyseliny. (pK A = 17,5).
![]()
Pod vplyvom takého aktívneho kovu, ako je draslík, sa môže pripraviť jeho draselná soľ, pyrol-draslík.
Kyslé vlastnosti N-H väzby pyrolového kruhu vysvetľujú najmä schopnosť porfínu a jeho prírodných derivátov vytvárať soli s katiónmi kovov. Dva pyrolové kruhy molekuly porfyrínu sú koordinované s katiónom v dôsledku elektrónových párov ich atómov dusíka a ďalšie dva sú koordinované nahradením atómov vodíka, ako samotná molekula pyrolu počas tvorby pyrolu-draslíka. Tieto soli sú chlorofyl a hemoglobín.

Podľa povahy uhľovodíkových substituentov sa amíny delia na
Všeobecné štruktúrne vlastnosti amínov
Rovnako ako v molekule amoniaku, v molekule akéhokoľvek amínu má atóm dusíka jediný elektrónový pár nasmerovaný na jeden z vrcholov skresleného štvorstenu:
Z tohto dôvodu majú amíny, podobne ako amoniak, výrazne vyjadrené základné vlastnosti.
Amíny, podobne ako amoniak, teda reagujú reverzibilne s vodou a vytvárajú slabé zásady:
Väzba medzi katiónom vodíka a atómom dusíka v molekule amínu sa realizuje pomocou mechanizmu donor-akceptor v dôsledku osamelého elektrónového páru atómu dusíka. Nasýtené amíny sú silnejšie zásady v porovnaní s amoniakom, pretože v takýchto amínoch majú uhľovodíkové substituenty pozitívny indukčný (+I) účinok. V tomto ohľade sa zvyšuje hustota elektrónov na atóme dusíka, čo uľahčuje jeho interakciu s katiónom H +.
Aromatické amíny, ak je aminoskupina priamo napojená na aromatický kruh, vykazujú slabšie zásadité vlastnosti v porovnaní s amoniakom. Je to spôsobené tým, že osamelý elektrónový pár atómu dusíka je posunutý smerom k aromatickému π-systému benzénového kruhu, v dôsledku čoho klesá hustota elektrónov na atóme dusíka. To zase vedie k zníženiu základných vlastností, najmä schopnosti interagovať s vodou. Napríklad anilín reaguje iba so silnými kyselinami, ale prakticky nereaguje s vodou.
Chemické vlastnosti nasýtených amínov
Ako už bolo uvedené, amíny reagujú s vodou reverzibilne:
Vodné roztoky amínov majú alkalickú reakciu v dôsledku disociácie výsledných zásad:
Nasýtené amíny reagujú s vodou lepšie ako amoniak vďaka svojim silnejším zásaditým vlastnostiam.
Základné vlastnosti nasýtených amínov sa postupne zvyšujú.
Sekundárne nasýtené amíny sú silnejšie zásady ako primárne nasýtené amíny, ktoré sú zase silnejšie zásady ako amoniak. Pokiaľ ide o základné vlastnosti terciárnych amínov, ak hovoríme o reakciách vo vodných roztokoch, potom základné vlastnosti terciárnych amínov sú vyjadrené oveľa horšie ako vlastnosti sekundárnych amínov a dokonca o niečo horšie ako vlastnosti primárnych. Je to spôsobené stérickou zábranou, ktorá výrazne ovplyvňuje rýchlosť protonácie amínu. Inými slovami, tri substituenty „blokujú“ atóm dusíka a interferujú s jeho interakciou s H+ katiónmi.
Interakcia s kyselinami
Voľné nasýtené amíny aj ich vodné roztoky reagujú s kyselinami. V tomto prípade sa tvoria soli:
Pretože základné vlastnosti nasýtených amínov sú výraznejšie ako vlastnosti amoniaku, tieto amíny reagujú aj so slabými kyselinami, ako je kyselina uhličitá:
Amínové soli sú pevné látky, ktoré sú vysoko rozpustné vo vode a slabo rozpustné v nepolárnych organických rozpúšťadlách. Interakcia amínových solí s alkáliami vedie k uvoľňovaniu voľných amínov, podobne ako vytesňovanie amoniaku, keď alkálie pôsobia na amónne soli:
2. Primárne nasýtené amíny reagujú s kyselinou dusitou za vzniku zodpovedajúcich alkoholov, dusíka N2 a vody. Napríklad:
Charakteristickým znakom tejto reakcie je tvorba plynného dusíka, a preto je pre primárne amíny kvalitatívny a používa sa na ich odlíšenie od sekundárnych a terciárnych. Je potrebné poznamenať, že táto reakcia sa najčastejšie uskutočňuje zmiešaním amínu nie s roztokom samotnej kyseliny dusitej, ale s roztokom soli kyseliny dusitej (dusitanu) a potom pridaním silnej minerálnej kyseliny do tejto zmesi. Keď dusitany interagujú so silnými minerálnymi kyselinami, vzniká kyselina dusitá, ktorá potom reaguje s amínom:
Sekundárne amíny za podobných podmienok dávajú olejovité kvapaliny, takzvané N-nitrozamíny, ale táto reakcia sa nevyskytuje v skutočných USE testoch v chémii. Terciárne amíny nereagujú s kyselinou dusitou.
Úplné spaľovanie akýchkoľvek amínov vedie k tvorbe oxidu uhličitého, vody a dusíka:
Interakcia s halogénalkánmi
Je pozoruhodné, že presne rovnaká soľ sa získa pôsobením chlorovodíka na viac substituovaný amín. V našom prípade, keď chlorovodík reaguje s dimetylamínom:
Príprava amínov:
1) Alkylácia amoniaku halogénalkánmi:
V prípade nedostatku amoniaku sa namiesto amínu získava jeho soľ:
2) Redukcia kovmi (na vodík v rade aktivít) v kyslom prostredí:
s následným spracovaním roztoku s alkáliou, aby sa uvoľnil voľný amín:
3) Reakcia amoniaku s alkoholmi pri prechode ich zmesi cez zahriaty oxid hlinitý. V závislosti od pomeru alkohol/amín sa tvoria primárne, sekundárne alebo terciárne amíny:
Chemické vlastnosti anilínu
anilín - triviálny názov aminobenzénu, ktorý má vzorec:
Ako je možné vidieť z ilustrácie, v anilínovej molekule je aminoskupina priamo spojená s aromatickým kruhom. Takéto amíny, ako už bolo uvedené, majú oveľa menej výrazné základné vlastnosti ako amoniak. Teda najmä anilín prakticky nereaguje s vodou a slabými kyselinami ako je kyselina uhličitá.
Reakcia anilínu s kyselinami
Anilín reaguje so silnými a stredne silnými anorganickými kyselinami. V tomto prípade sa tvoria fenylamóniové soli:
Reakcia anilínu s halogénmi
Ako už bolo povedané na samom začiatku tejto kapitoly, aminoskupina v aromatických amínoch je vtiahnutá do aromatického kruhu, čo následne znižuje hustotu elektrónov na atóme dusíka a v dôsledku toho ju zvyšuje v aromatickom kruhu. Zvýšenie hustoty elektrónov v aromatickom kruhu vedie k tomu, že elektrofilné substitučné reakcie, najmä reakcie s halogénmi, prebiehajú oveľa ľahšie, najmä v orto a para polohe vzhľadom na aminoskupinu. Anilín teda ľahko reaguje s brómovou vodou za vzniku bielej zrazeniny 2,4,6-tribrómanilínu:
Táto reakcia je pre anilín kvalitatívna a často umožňuje jeho identifikáciu medzi inými organickými zlúčeninami.
Reakcia anilínu s kyselinou dusitou
Anilín reaguje s kyselinou dusitou, ale vzhľadom na špecifickosť a zložitosť tejto reakcie sa v skutočnej jednotnej štátnej skúške z chémie neobjavuje.
Alkylačné reakcie anilínu
Pomocou sekvenčnej alkylácie anilínu na atóme dusíka halogénovanými uhľovodíkmi možno získať sekundárne a terciárne amíny:
Chemické vlastnosti aminokyselín
Aminokyseliny sú zlúčeniny, ktorých molekuly obsahujú dva typy funkčných skupín - amino (-NH 2) a karboxy- (-COOH) skupiny.
Inými slovami, aminokyseliny možno považovať za deriváty karboxylových kyselín, v ktorých molekulách je jeden alebo viac atómov vodíka nahradených aminoskupinami.
Všeobecný vzorec aminokyselín teda možno zapísať ako (NH2) x R(COOH) y, kde x a y sa najčastejšie rovnajú jednej alebo dvom.
Pretože molekuly aminokyselín obsahujú aminoskupinu aj karboxylovú skupinu, vykazujú chemické vlastnosti podobné amínom aj karboxylovým kyselinám.
Kyslé vlastnosti aminokyselín
Tvorba solí s alkáliami a uhličitanmi alkalických kovov
Esterifikácia aminokyselín
Aminokyseliny môžu reagovať s esterifikáciou s alkoholmi:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Základné vlastnosti aminokyselín
1. Tvorba solí pri interakcii s kyselinami
NH 2 CH 2 COOH + HCl → + Cl —
2. Interakcia s kyselinou dusitou
NH2-CH2-COOH + HNO2 → HO-CH2-COOH + N2 + H20
Poznámka: interakcia s kyselinou dusitou prebieha rovnakým spôsobom ako s primárnymi amínmi
3. Alkylácia
NH 2 CH 2 COOH + CH 3 I → + I —
4. Vzájomná interakcia aminokyselín
Aminokyseliny môžu navzájom reagovať za vzniku peptidov - zlúčenín obsahujúcich vo svojich molekulách peptidovú väzbu –C(O)-NH-.
Zároveň je potrebné poznamenať, že v prípade reakcie medzi dvoma rôznymi aminokyselinami, bez dodržania niektorých špecifických podmienok syntézy, dochádza súčasne k tvorbe rôznych dipeptidov. Napríklad namiesto vyššie uvedenej reakcie glycínu s alanínom, ktorá vedie ku glycylananínu, môže dôjsť k reakcii vedúcej k alanylglycínu:
Okrem toho molekula glycínu nemusí nutne reagovať s molekulou alanínu. Peptizačné reakcie sa vyskytujú aj medzi molekulami glycínu:
A alanín:
Navyše, keďže molekuly výsledných peptidov, podobne ako pôvodné molekuly aminokyselín, obsahujú aminoskupiny a karboxylové skupiny, môžu samotné peptidy reagovať s aminokyselinami a inými peptidmi v dôsledku tvorby nových peptidových väzieb.
Jednotlivé aminokyseliny sa používajú na výrobu syntetických polypeptidov alebo takzvaných polyamidových vlákien. Najmä pomocou polykondenzácie kyseliny 6-aminohexánovej (ε-aminokaprónovej) sa nylon syntetizuje v priemysle:
Výsledná nylonová živica sa používa na výrobu textilných vlákien a plastov.
Tvorba vnútorných solí aminokyselín vo vodnom roztoku
Vo vodných roztokoch sa aminokyseliny vyskytujú prevažne vo forme vnútorných solí - bipolárnych iónov (zwitterióny).
Každý amín má na svojom atóme dusíka osamelý elektrónový pár. Keď amín vstúpi do vody, protóny z vody môžu prostredníctvom mechanizmu donor-akceptor vytvoriť novú kovalentnú polárnu väzbu s atómom dusíka, čím sa vytvorí alkyl- alebo arylamóniový ión. Voda, ktorá stratila protón, sa stáva hydroxidovým iónom. Prostredie sa stáva zásaditým. Amíny sú teda zásady. Sila týchto zásad závisí od povahy a počtu radikálov spojených s dusíkom. Alifatické radikály, ako je metyl, etyl, atď., ktoré vykazujú svoje elektrón-donorové vlastnosti, zvyšujú zásaditosť amínov. Aromatické radikály v dôsledku delokalizácie páru elektrónov na benzénovom kruhu naopak zásaditosť výrazne znižujú. Z hľadiska rezonančnej teórie Linusa Paulinga to vyzerá takto:
Ako vidíte, osamelý pár elektrónov je prítomný na atóme dusíka iba v jednej z rezonančných štruktúr (mezomérnych foriem). V ostatných troch bipolárnych štruktúrach je naopak na atóme dusíka „+“ - náboj, ktorý prirodzene bráni protonácii. To je dôvod prudkého poklesu zásaditosti. Dostupnosť v O- A P- polohy záporných nábojov nám umožňuje urobiť predpoklad o ľahkosti elektrofilných substitučných reakcií, ktoré sa vyskytujú práve v týchto polohách, kde je útočiacou časticou katión (napr.
![]() ) Nižšie sú uvedené príklady reakcií tohto typu s aromatickými amínmi.
) Nižšie sú uvedené príklady reakcií tohto typu s aromatickými amínmi.
Kvantitatívne je sila báz charakterizovaná hodnotami Kb alebo ich zápornými logaritmami pKb. Index „b“ znamená, že hovoríme o rovnovážnej konštante medzi bázou, ktorou je amín, a jej konjugovanou kyselinou, teda amónnym iónom:
Podľa definície je takáto reverzibilná reakcia opísaná analytickým výrazom:

Pretože koncentrácia vody v zriedených vodných roztokoch je prakticky konštantná a rovná sa 55,5 mol/l, potom je zahrnutá do „novej“ rovnovážnej konštanty:

Vynásobením čitateľa a menovateľa pravej strany rovnice [H + ] a berúc do úvahy, že [H + ] [OH - ] = K w = 10 -14 dostaneme:

Logaritmizácia tohto analytického výrazu pomocou desiatkových logaritmov,
dostávame sa k rovnici:

Zmenou znamienok na opak a zavedením všeobecne akceptovaného zápisu: - lg = p, dostaneme:

Pretože logaritmus jednoty v akejkoľvek báze je rovný nule a 14 je pH = pOH, je zrejmé, že pKb zodpovedá hodnote koncentrácie hydroxylových iónov, pri ktorej polovica amónnych katiónov prejde odstránením a protón na voľný amín. Hodnota pKb pre zásady má rovnaký význam ako hodnota pKa pre kyseliny. Nižšie je uvedená tabuľka, ktorej údaje ukazujú vplyv povahy radikálov a ich množstva na hodnoty konštánt zásaditosti rôznych amínov.
| Základný názov | Základný vzorec | Základný typ | Kb pri 25 °C | Hodnota pKb pri 25 °C |
| Amoniak | 1,75 10 -5 | 4,75 | ||
| metylamín | Primárny alifát | 4,60 10 - 4 | 3,34 | |
| Etylamin | | Primárny alifát | 6,50 10 - 4 | 3,19 |
| Butylamín | Primárny alifát | 4,00 10 - 4 | 3,40 | |
| izobutiamín | | Primárny alifát | 2,70 10 - 4 | 3,57 |
| nem.-butylamín | | Primárny alifát | 3,60 10 - 4 | 3,44 |
| Tret-butylamín | Primárny alifát | 2,80 10 - 4 | 3,55 | |
| Benzylamín | | Primárny alifát | 2,10 10 -5 | 4,67 |
| Dimetylamín | Sekundárne alifát | 5,40 10 -4 | 3,27 | |
| dietylamín | Sekundárne alifát | 1,20 10 - 3 | 2,91 | |
| trimetylamín | treťohorný alifát | 6,50 10 -5 | 4,19 | |
| trietylamín | | treťohorný alifát | 1,00 10 - 3 | 3,00 |
| anilín | Primárny aróma. | 4,30 10 - 10 | 9,37 | |
| P-toluidín | | Primárny aróma. | 1,32 10 -9 | 8,88 |
| P-nitroanilín | | Primárny aróma. | 1,00 10 - 13 | 13,0 |
| N,N-dimetylanilín | treťohorný mastné aromatické | 1,40 10 -9 | 8,85 | |
| difenylamín | Sekundárne aróma. | 6,20 10 -14 | 13,21 | |
| Pyridín | Heteroaromatické | 1,50 10 - 9 | 8,82 | |
| Chinolín | Heteroaromatické | 8,70 10 -10 | 9,06 | |
| piperidín | Sekundárne alifát a heterocyklické | 1,33 10 -3 | 3,88 | |
| Hydrazín | 9,30 10 -7 | 6,03 | ||
| Hydroxylamín | 8,90 10 - 9 | 8,05 | ||
| Etanolamín | Prod. najprv alif. | 1,80 10 - 5 | 4,75 |
Tieto tabuľky nám umožňujú vyvodiť nasledujúce závery:
1) Alifatické amíny sú oveľa silnejšie zásady ako aromatické amíny (asi 100 000 - 1 000 000 krát)
2) Heteroaromatické amíny sú zásaditou blízke aromatickým.
3) Zásaditosť aromatických amínov je silne ovplyvnená substituentmi nachádzajúcimi sa v pár- poloha k aminoskupine. Substituenty poskytujúce elektróny zvyšujú zásaditosť amínu, zatiaľ čo substituenty priťahujúce elektróny ju prudko znižujú. Pomer zásaditosti aromatických amínov obsahujúcich metylové a nitroskupiny v uvedenej polohe je približne 10 000:1.
4) Sekundárne alifatické amíny sú o niečo zásaditejšie ako primárne amíny, zatiaľ čo terciárne alifatické amíny majú zásaditosť na rovnakej úrovni.
5) Povaha radikálu v primárnych amínoch významne neovplyvňuje zásaditosť amínu.
6) Nasýtené heterocyklické amíny majú zásaditosť na úrovni sekundárnych alifatických amínov.
7) Mastné aromatické amíny majú zásaditosť na úrovni aromatických amínov.
8) Sekundárne aromatické amíny majú zásaditosť približne 10 000-krát menšiu ako primárne.
9) Elektronegatívne atómy viazané v molekule na atóm dusíka aminoskupiny znižujú jej zásaditosť 10-krát (dusík) a 1000-krát (kyslík).
10) Atóm kyslíka oddelený od aminoskupiny dvoma metylénovými skupinami znižuje svoju zásaditosť len 67-krát.
Malo by sa tiež poznamenať, že zásaditosť amidov kyselín v dôsledku účinku karbonylovej skupiny na odoberanie elektrónov je veľmi nízka - dokonca nižšia ako u sekundárnych aromatických amínov: pre acetamid pKb = 13,52; pre acetanilid pKb = 13,60 a pre močovinu pKb = 13,82
acetamid acetanilid močovina
Ako dôvody primárne, sekundárne a terciárne amíny reagovať s kyselinami:
propylamín propylamónium bromid
dimetylamín dimetylamónium sulfát
trimetylamín trimetylamónium chloristan
S viacsýtnymi kyselinami možno vytvárať nielen priemery, ale a kyslé soli:
dimetylamín dimetylamónium hydrogénsíran
metylizobutylamín metylizobutylamóniumdihydrogénortofosfát
Primárne aromatické látky, a sekundárne a terciárne mastné aromatické amíny so zriedenými vodnými roztokmi silných kyselín tiež dávajú soľ:


Sú tiež schopné formovania soľ Pod vplyvom koncentrované silné kyseliny, ale pri zriedený vodou tieto soli hydrolyzovať, dávajúc slabý základ, tzn materský amín:

Ako veľmi slabé základy, nedávajte soli ani s koncentrovanou kyselinou chlorovodíkovou ani sírovou. Je pravda, že trifenylamín stále produkuje chloristan s kyselinou chloristou:

.
Primárne alifatické amíny reagovať v dvoch fázach: v prvej extrémne nestabilná vo vode aj po vychladnutí diazóniová soľ, ktorý v druhom stupni reaguje s vodou za vzniku alkohol:
propylamín propyldiazóniumchlorid
propanol-1
Pri reakcii primárneho amínu s dusitanom sodným a kyselinou chlorovodíkovou, vývoj plynu(bubliny sú jasne viditeľné) a rybí zápach zmeny amínov na alkohol je kvalitatívna reakcia na primárny alifatický amín.
Ak zhrnieme vyššie uvedené dve reakcie, dostaneme:
Sekundárne amíny reagovať úplne inak: pod vplyvom dusitanu sodného a kyseliny chlorovodíkovej, N-nitrozamín- veľmi stabilné pripojenie aj pri zahrievaní:
metyletylamín N-nitrózometyletiamín
Pri reakcii sekundárneho alifatického amínu s dusitanom sodným a kyselinou chlorovodíkovou, tvorba žltého oleja, slabo rozpustného vo vode a mimoriadne nepríjemného zápachu je kvalitatívna reakcia na sekundárny alifatický amín.
Nitrozamíny - karcinogény: bez ohľadu na miesto a spôsob vstupu do tela pokusného zvieraťa spôsobujú rakovinu pečene. Široko používaný v experimentálnej onkológii. Pôsobia resorpčne, teda cez kožu.
Terciárne alifatické amíny reagovať zo zmesi dusitanu sodného a kyseliny chlorovodíkovej len s kyselinou:
Táto reakcia nemá žiadne viditeľné účinky. Vôňa slabne.
Primárne aromatické amíny reagovať za vzniku relatívne stabilne pri teplotách od 0 do 5 o C diazóniové soli. Táto reakcia bola prvýkrát publikovaná v roku 1858 v nemeckom chemickom časopise Petrom Griessom a nesie jeho meno:
Griessova reakcia zahŕňa množstvo homológov anilínu obsahujúcich alkylové substituenty o-,m- A P- poloha k aminoskupine:
Patria sem aj deriváty anilínu obsahujúce substituenty priťahujúce elektróny, donory elektrónov a substituenty špeciálnej skupiny, napríklad:
S kyselinou bromovodíkovou je reakcia rýchlejšia, ale používa sa len zriedka a iba v laboratóriu kvôli vysokej cene a nedostatku tejto kyseliny.
Pri výrobe diazóniových solí sa okamžite používajú na nasledujúce stupne syntézy, ale v laboratóriu sa často izolujú výmennou reakciou s nasýteným roztokom tetrafluórboritanu sodného:

Diazóniové soli sa najčastejšie používajú na získanie mnohých azofarbív azo-kondenzáciou s fenolmi (naftolmi) a aromatickými terciárnymi amínmi, napríklad:


Výsledné azofarbivo je indikátorom pH: v kyslom prostredí má v dôsledku tvorby vodíkovej väzby plochú štruktúru, v ktorej je oslabený elektrónový donorový účinok hydroxylovej skupiny – táto forma je sfarbená do žlta. V alkalickej skupine sa z hydroxylovej skupiny odstráni protón, objaví sa „fenolátový ión“, ktorý je najsilnejším ED substituentom, a farba sa zmení na červeno-oranžovú:

Úlohou sódy pri azokopulačnej reakcii je naviazanie výslednej kyseliny chlorovodíkovej (alebo inej silnej) kyseliny na kyslú soľ - hydrogénuhličitan sodný:
Zmes uhličitanu sodného a hydrogénuhličitanu sodného je tlmivý roztok, ktorý vytvára mierne zásadité prostredie.
Pri terciárnych aromatických amínoch musí azokopulácia prebiehať v mierne kyslom prostredí, čo je zabezpečené prídavkom solí, ktoré hydrolyzujú na anióne, napríklad octanu sodného. V silne kyslom prostredí amín vytvára amónnu soľ, ktorej katión prirodzene nereaguje s diazóniovým katiónom.


Octan sodný okamžite reaguje s výslednou kyselinou chlorovodíkovou. Výsledkom je tlmivý roztok pozostávajúci zo slabej kyseliny octovej a prebytku octanu sodného. Poskytuje mierne kyslé prostredie:
Sekundárne aromatické amíny reagovať s dusitanom sodným a kyselinou chlorovodíkovou so vzdelaním N-nitrozamíny. Napríklad N-metylanilín poskytuje N-nitrózo-N-metylanilín, žltý olej s mimoriadne nepríjemným zápachom, ktorý tuhne pri 13 °C:
Aromatické N-nitrózoamíny, podobne ako alifatické, sú karcinogény. Spôsobujú aj rakovinu pečene a využívajú sa aj v experimentálnej onkológii.
Aromatické N-nitrózoamíny pôsobením suchého chlórovodíka alebo bromidu alebo pôsobením koncentrovanej kyseliny sírovej prechádzajú preskupením, prvýkrát publikovaným v roku 1886 v nemeckom chemickom časopise O. Fischerom a E. Heppom. Za týchto podmienok sa nitrózoskupina selektívne prenesie na P-pozícia:
4-Nitrózo-N-metylanilín získaný preskupením má úplne iné fyzikálne vlastnosti a biologickú aktivitu. Je to zelená pevná látka s teplotou topenia 113 °C V roztokoch v organických rozpúšťadlách fluoreskuje. Nie je to karcinogén, hoci spôsobuje dermatitídu.
Terciárne aromatické amíny reagovať s dusitanom sodným a kyselinou chlorovodíkovou, dávať C-nitrózozlúčeniny. Nitrózoskupina je selektívne zameraná na P-pozícia:
C-nitrózozlúčeniny sa ľahko redukujú vodíkom na Raneyovom nikle. Takto vznikajú nesymetrické dialkyldiamíny, napríklad:
Soli alifatických a aromatických amínov možno ľahko premeniť späť na amíny pôsobením zásad, napr.
propylamónium chloristan propylamín
metylpropylamóniumhydrogensíran metylpropylamín

kvartérne amóniové zásady, naopak, možno preložiť do kvartérne amóniové soli akcie kyseliny:
Dimetyletylizopropylamóniumhydroxid dimetyletylizopropylamóniumchlorid
Ako vidíte, ide o bežnú reakciu neutralizácie zásady kyselinou - získa sa soľ a voda.
Na strane 19 tejto príručky bolo navrhnuté, že elektrofilné substitučné reakcie v aromatických amínoch ľahko prebiehajú orto- A pár- poloha benzénového kruhu. V skutočnosti sa anilín ľahko brómuje vo všetkých týchto polohách naraz:

N,N-dialkylanilíny sú sulfonované, nitrované a diazotované orto- A pár- pozície:




Octan sodný premieňa silnú komplexnú kyselinu na slabú kyselinu: kyselinu octovú:
Aplikácia amínov
Najjednoduchší primárny amín je metylamín používa sa pri syntéze insekticídov, fungicídov, urýchľovačov vulkanizácie, povrchovo aktívnych látok, liekov, farbív, raketových palív a rozpúšťadiel. Napríklad N-metyl-2-pyrolidón, obľúbené rozpúšťadlo pre laky a niektoré farbivá, sa získava reakciou metylamínu s y-butyrolaktónom (cyklický ester kyseliny 4-hydroxybutánovej):

y-butyrolát N-metyl-2-pyrolidón
Najjednoduchší sekundárny amín je dimetylamín používa sa pri syntéze insekticídov, herbicídov, urýchľovačov vulkanizácie, povrchovo aktívnych látok, mnohých liečiv, farbív a takých dôležitých rozpúšťadiel ako je dimetylforiamid (DMF), dimetylacetamid (DMAA) a hexametylfosfortriamid (HMPTA) alebo hexametapol. DMF sa priemyselne vyrába napríklad reakciou dimetylamínu s metylesterom kyseliny mravčej:
metylformiát dimetylamín DMF metanol
DMAA sa priemyselne vyrába reakciou dimetylamínu s acetanhydridom:
acetanhydrid DMAA
Priemyselná syntéza hexamethapolu zahŕňa interakciu dimetylamínu s oxychloridom fosforečným:

chlorid fosforitý HMPTA
Najjednoduchší terciárny amín je trimetylamín používa sa pri syntéze kvartérnych amóniových báz, flotačných činidiel, retardérov, kŕmnych prísad. Napríklad posledná fáza syntézy karbacholínu, liečiva používaného pri liečbe glaukómu a pooperačnej atónie čriev alebo močového mechúra, zahŕňa interakciu trimetylamínu s karbamoylovým derivátom etylénchlórhydrínu:
karbacholín
Katiónové povrchovo aktívne látky sa získajú podobne:
trimetylalkylamóniumchlorid
Etylamin používa sa pri výrobe farbív, povrchovo aktívnych látok, herbicídov. Napríklad simazín, herbicíd na ochranu kukurice a zeleniny pred burinou, sa získava reakciou etylamínu s vypočítaným množstvom kyanurchloridu v alkalickom prostredí:
chlorokyanur simazín
dietylamín používa sa pri výrobe farbív, pesticídov, urýchľovačov vulkanizácie gumy, inhibítorov korózie, liekov a repelentov. Napríklad známy repelent proti komárom DEET sa získa reakciou:

chlorid kyseliny m- kyselina toluová N,N-dietyl- m-toluamid
Izopropylamín, butylamín, izobutylamín, utorok-butiamín a tert- butylamíny používané v podobných odvetviach.
1,6-hexándiamínširoko používané na syntézu nylonu polykondenzačnou reakciou s kyselinou 1,4-butándikarboxylovou (adipovou):

Spomedzi liekov mnohé obsahujú aminoskupiny rôznych typov. Takže napríklad z 1308 liekov uvedených v referenčnej knihe M.D. Mashkovsky, najmenej 70 sú primárne amíny, najmenej 52 sú sekundárne a najmenej 108 sú terciárne. Okrem toho medzi liečivami je 41 kvartérnych amóniových solí a viac ako 70 amidov karboxylových kyselín, 26 amidov arylsulfónových kyselín a 12 amidov derivátov kyseliny ortofosforečnej. Existujú aj cyklické amidy - laktámy. Je tam 5 mien. Deriváty prírodných aminokyselín – 14 názvov. Nižšie sú uvedené príklady liekov obsahujúcich uvedené funkčné skupiny:
Anestezin– etyléter P- kyselina aminobenzoová. Je to primárny aromatický amín a zároveň ester.

Má lokálny anestetický účinok. Používa sa na zmiernenie bolesti pri ranách a vredoch, pri zvracaní v tehotenstve, pri morských a vzdušných chorobách.
baklofén– 4-amino-3-( P kyselina -chlór)fenylbutánová. Je to primárny alifatický amín, ester a zároveň halogénový derivát benzénového radu.

Znižuje svalové napätie a má analgetický účinok. Používa sa pri skleróze multiplex.
salbutamol – 2-drhne-butylamino-1-(4"-hydroxy-3"-hydroxymetyl)fenyletanol. Ide o sekundárny alifatický amín, sekundárne a primárne alkoholy a zároveň fenol.

Má bronchodilatačný účinok a zabraňuje predčasným kontrakciám u tehotných žien. Používa sa pri bronchiálnej astme a v pôrodníckej praxi.
Ortofen– sodná soľ kyseliny 2-(2",6"-dichlór)fenylaminofenyloctovej. Je to sekundárny aromatický amín, soľ karboxylovej kyseliny a súčasne halogénový derivát benzénového radu.

Má protizápalové, analgetické a antipyretické účinky. Používa sa pri akútnom reumatizme, reumatoidnej artritíde, ankylozujúcej spondylitíde, artróze, spondyloartróze.
Isoverine– N-izoamyl-1,5-pentándiamín dihydrochlorid. Je to diamónna soľ primárnych a sekundárnych amínov súčasne.

Znižuje krvný tlak, zvyšuje tonus a zvyšuje kontrakcie svalov maternice. Používa sa ako urýchľovač pôrodu a na stimuláciu kontrakcií maternice v popôrodnom období.
Metylénová modrá- N,N,N',N'-tetrametyltionínchlorid. Je to ako terciárny mastný aromatický amín, tak aj amónna soľ toho istého amínu. Okrem toho obsahuje heteroaromatický kruh s atómom dusíka „pyridínu“.

Používa sa zvonka ako antiseptikum na popáleniny, pyodermiu a folikulitídu. Pri cystitíde a uretritíde sa dutiny premyjú 0,02 % modrým roztokom.
Pentamín– 3-metyl-1,5-bis-(N,N-dimetyl-N-etyl)amónium-3-azapentándibromid. Je to ako terciárny alifatický amín, tak aj dvojitá kvartérna amóniová soľ tých istých amínov.

Má aktivitu blokovania ganglií. Používa sa pri hypertenzných krízach, kŕčoch periférnych ciev, kŕčoch čriev a žlčových ciest, obličkových kolikách, na zmiernenie akútnych záchvatov bronchiálnej astmy a pri edémoch pľúc a mozgu.
nikotínamid– amid 3-pyridínkarboxylovej kyseliny. Je to amid karboxylovej kyseliny a derivát heteroaromatického kruhu obsahujúceho dusík – pyridín.

Má antipellagrické vlastnosti, zlepšuje metabolizmus uhľohydrátov, priaznivo pôsobí pri ľahkých formách cukrovky, ochoreniach pečene a srdca, pri žalúdočných a dvanástnikových vredoch. Používa sa pri gastritíde s nízkou kyslosťou, akútnej a chronickej hepatitíde, cirhóze, pri kŕčoch ciev končatín, obličiek a mozgu.
Sulfadimezin – 2-(P- aminobenzénsulfamido)-4,6-dimetylpyrimidín. Predstaviteľ veľkej skupiny sulfónamidových liečiv. Je to sulfanilamid, primárny aromatický amín a derivát heteroaromatického kruhu obsahujúceho dusík – pyrimidín.

Rovnako ako všetky lieky v tejto skupine je sulfadimezín aktívnym antimikrobiálnym činidlom. Používa sa pri pneumokokových, streptokokových, meningokokových infekciách, sepse, kvapavke, ako aj pri infekciách spôsobených E. coli a inými mikróbmi.
Fopurín – 6-dietylénamidofosfamido-2-dimetylamino-7-metylpurín. Je to súčasne trojitý fosfamid, terciárny aromatický amín a derivát heteroaromatického bicykla obsahujúceho dusík - purín
Hemodez– 6 % vodno-solný roztok polyvinylpyrolidónu s nízkou molekulovou hmotnosťou. Elementárna jednotka polyméru obsahuje laktámový kruh.

Viaže toxíny cirkulujúce v krvi a rýchlo ich odstraňuje cez renálnu bariéru. Používa sa na úplavicu, dyspepsiu, salmonelózu a popáleniny vo fáze intoxikácie.
histidín– L-β-imidazolylalanín alebo kyselina L-α-amino-β-(4-imidazolyl)propiónová. Je to α-aminokyselina a derivát heteroaromatického kruhu obsahujúceho dusík – imidazol

Histidín je esenciálna aminokyselina; Nachádza sa v rôznych orgánoch a je súčasťou karnozínu, dusíkatej extrakčnej látky vo svaloch. V tele podlieha dekarboxylácii za vzniku histamínu, jedného z chemických faktorov (mediátorov) podieľajúcich sa na regulácii životných funkcií.
Angiotenzínamid– L-asparaginyl-L-arginyl-L-valyl-L-tyrozinyl-L-valyl-L-histidinylacetát – L-prolyl-L-fenylalanín. Je to soľ oktapeptidu s kyselinou octovou pozostávajúcou z prírodných α-aminokyselín.

V šokových podmienkach sa používa na rýchle a silné stiahnutie ciev vo vnútorných orgánoch, koži a obličkách. Angiotenzínamid má tiež schopnosť sťahovať hladké svaly maternice, čriev, močového mechúra a žlčníka. Stimuluje uvoľňovanie adrenalínu z nadobličiek a tvorbu aldosterónu.
| Amines. Definícia | |
| Klasifikácia amínov podľa počtu atómov vodíka v amoniaku nahradených radikálmi | |
| Klasifikácia amínov podľa povahy radikálov spojených s atómom dusíka | |
| Izoméria a nomenklatúra alifatických amínov | |
| Spôsoby výroby amínov | |
| Príprava amínov z iných zlúčenín obsahujúcich dusík | |
| Z nitrozlúčenín | |
| Z nitrózozlúčenín | |
| Z oxímov | |
| Z hydrazónov | |
| Z amidov karboxylových kyselín | |
| Z nitrilov karboxylových kyselín: 7 | |
| Príprava amínov zo zlúčenín iných tried | |
| Z aldehydov a ketónov Leuckartovou-Wallachovou reakciou | |
| Príprava primárnych alifatických amínov alkyláciou amoniaku | |
| Príprava sekundárnych alifatických amínov alkyláciou primárnych | |
| Príprava terciárnych alifatických amínov alkyláciou sekundárnych | |
| Príprava kvartérnych amóniových solí z terciárnych amínov | |
| Príprava kvartérnych amóniových báz z kvartérnych amóniových solí | |
| Termolýza kvartérnych amóniových zásad | |
| Alkylácia primárnych aromatických amínov na symetrické | |
| terciárne amíny | |
| Štvorstupňová syntéza sekundárnych mastných aromatických amínov | |
| Príprava čistých primárnych amínov podľa Gabriela | |
| Príprava amínov z alkoholov | |
| Príprava aromatických amínov | |
| Redukcia aromatických nitrozlúčenín podľa N.N. Zinina | |
| Redukcia aromatických nitrozlúčenín podľa Bechampa | |
| Katalytická redukcia aromatických nitrozlúčenín vodíkom | |
| Fyzikálne vlastnosti alifatických amínov | |
| Fyzikálny stav alifatických amínov | |
| Závislosť teplôt varu alifatických amínov od štruktúry | |
| Rozpustnosť alifatických amínov vo vode a organických rozpúšťadlách | |
| Fyzikálne vlastnosti aromatických amínov | |
| Fyzikálny stav a rozpustnosť aromatických amínov | |
| Chemické vlastnosti amínov | |
| Vzťah medzi elektrónovou štruktúrou amínov a zásaditosťou | |
| Konštanty zásaditosti a hodnoty pKb pre alifatické, aromatické a heterocyklické amíny a niektoré príbuzné zlúčeniny | |
| Reakcie amínov s kyselinami | |
| Interakcia amínov s dusitanom sodným a kyselinou chlorovodíkovou | |
| Konverzia primárnych alifatických amínov na alkoholy cez diazozlúčeniny | |
| Konverzia sekundárnych alifatických amínov na N-nitrózozlúčeniny | |
| Karcinogenita alifatických N-nitrozamínov | |
| Interakcia terciárnych alifatických amínov s dusitanom sodným | |
| a kyselina chlorovodíková | |
| Konverzia primárnych aromatických amínov na diazóniové soli | |
| Izolácia diazóniových solí z roztokov vo forme tetrafluórboritanov | |
| Azokondenzačná reakcia s fenolmi (naftolmi) | |
| Azofarbivá ako indikátory pH | |
| Azokondenzačná reakcia s terciárnymi aromatickými amínmi | |
| Konverzia sekundárnych mastných aromatických amínov na N-nitrozamíny | |
| Karcinogenita mastných-aromatických N-nitrozamínov | |
| Fischer-Heppov prešmyk | |
| Konverzia terciárnych aromatických amínov na C-nitrózozlúčeniny | |
| Katalytická redukcia aromatických C-nitrózozlúčenín vodíkom | |
| Interakcia solí alifatických a aromatických amínov s alkáliami | |
| Interakcia kvartérnych amóniových zásad s kyselinami | |
| Elektrofilné substitučné reakcie v aromatických amínoch | |
| Aplikácia amínov | |
| Aplikácia metyl a dimetylamínov | |
| Príprava populárnych organických rozpúšťadiel: DMF, DMAA a HMPTA | |
| Aplikácia trimetyl a etylamínov | |
| Aplikácia dietylamínu | |
| Aplikácia diamínov na výrobu polyamidových polymérov | |
| Lieky – amíny a deriváty amínov | |
| Anestezin | |
| baklofén | |
| salbutamol | |
| Ortofen | |
| Isoverine | |
| Metylénová modrá | |
| Pentamín | |
| nikotínamid | |
| Sulfadimezin | |
| fopurín | |
| Hemodez | |
| histidín | |
| Angiotenzínamid | |
| Obsah |
Amíny sú jedinou triedou organických zlúčenín, ktoré sú výrazne zásadité. Amíny sú však slabé zásady. Teraz bude užitočné vrátiť sa k stolu. 12-1 pripomenúť tri definície kyselín a zásad. Podľa troch definícií zásaditosti možno rozlíšiť tri aspekty chemického správania amínov.
1. Amíny reagujú s kyselinami a pôsobia ako akceptory protónov:
Preto sú amíny Bronstedovými zásadami. 2. Amíny sú donory elektrónových párov (Lewisove bázy):

3. Vodné roztoky amínov sú teda amíny schopné pri interakcii s vodou vytvárať hydroxidové anióny

Preto sú amíny Arrheniovými zásadami. Hoci všetky amíny sú slabé zásady, ich zásaditosť závisí od povahy a počtu uhľovodíkových radikálov pripojených k atómu dusíka. Alkylamíny sú oveľa zásaditejšie ako aromatické amíny. Medzi alkylamínmi sú najzásaditejšie sekundárne, primárne sú o niečo menej zásadité, nasledujú terciárne amíny a amoniak. Vo všeobecnosti zásaditosť klesá v poradí:
Mierou zásaditosti látky je konštanta zásaditosti, čo je rovnovážna konštanta interakcie amínu s vodou (pozri Arrheniusovu definíciu zásaditosti vyššie). Keďže voda je prítomná vo veľkom nadbytku, jej koncentrácia sa neobjavuje vo vyjadrení zásaditej konštanty:

Čím silnejšia je báza, tým viac protónov sa odstráni z molekúl vody a tým vyššia je koncentrácia hydroxidových iónov v roztoku. Vyznačujú sa teda silnejšie bázy
veľké hodnoty K Hodnoty pre niektoré amíny sú uvedené nižšie:

Tieto hodnoty ilustrujú vzťah medzi zásaditosťou amínov a ich štruktúrou, o ktorej sa hovorilo vyššie. Najsilnejšou zásadou je sekundárny dimetylamín a najslabšou je aromatický amín anilín.
Aromatické amíny sú veľmi slabé bázy, pretože osamotený elektrónový pár atómu dusíka (ktorý určuje základné vlastnosti amínov) interaguje s -elektrónovým oblakom aromatického jadra, a preto je menej prístupný pre protón (alebo inú kyselinu). Vyššia zásaditosť sekundárnych amínov v porovnaní s primárnymi sa vysvetľuje tým, že alkylové skupiny vďaka svojmu pozitívnemu indukčnému účinku dodávajú elektróny cez -väzby k atómu dusíka, čo uľahčuje zdieľanie osamelého elektrónového páru. Dve alkylové skupiny prispievajú elektrónmi k atómu dusíka viac ako jedným, takže sekundárne amíny sú silnejšie bázy. Na základe toho by sa dalo očakávať, že terciárne amíny sú ešte silnejšie zásady ako sekundárne. Tento predpoklad je však opodstatnený len pre plynnú fázu a vo vodnom roztoku nie je zásaditosť terciárnych amínov taká vysoká. Je to pravdepodobne spôsobené solvatačnými efektmi.
Amíny sú slabé organické zásady. Ich zásaditosť je určená počtom a povahou organických substituentov pripojených k atómu dusíka. Prítomnosť aromatického kruhu prudko znižuje zásaditosť (hodnota amínov. Sekundárne amíny sú silnejšie zásady ako primárne a terciárne.
Aminy vstúpili do našich životov úplne nečakane. Donedávna išlo o toxické látky, ktorých zrážka môže viesť k smrti. A teraz, o sto a pol storočia neskôr, aktívne používame syntetické vlákna, tkaniny, stavebné materiály a farbivá na báze amínov. Nie, nestali sa bezpečnejšími, ľudia si ich jednoducho dokázali „skrotiť“ a podmaniť si ich, čím pre seba získali určité výhody. O ktorej si povieme ďalej.
Definícia
Na kvalitatívne a kvantitatívne stanovenie anilínu v roztokoch alebo zlúčeninách sa používa reakcia, na konci ktorej na dno skúmavky padá biela zrazenina vo forme 2,4,6-tribrómanilínu.
Amíny v prírode
Amíny sa nachádzajú všade v prírode vo forme vitamínov, hormónov a medziproduktov látkovej výmeny, nachádzajú sa v tele zvierat aj v rastlinách. Okrem toho pri rozklade živých organizmov vznikajú aj stredné amíny, ktoré v tekutom stave vydávajú nepríjemný zápach sleďovej soľanky. V literatúre široko opísaný „mŕtvolný jed“ sa objavil práve vďaka špecifickému jantáru amínov.
Látky, o ktorých sme uvažovali, boli dlho zamieňané s amoniakom kvôli ich podobnému zápachu. Ale v polovici devätnásteho storočia francúzsky chemik Wurtz dokázal syntetizovať metylamín a etylamín a dokázal, že pri spaľovaní uvoľňujú uhľovodíky. To bol zásadný rozdiel medzi spomínanými zlúčeninami a amoniakom.
Výroba amínov v priemyselných podmienkach
Keďže atóm dusíka v amínoch je v najnižšom oxidačnom stave, redukcia zlúčenín obsahujúcich dusík je najjednoduchším a najdostupnejším spôsobom, ako ich získať. Práve tento typ je široko používaný v priemyselnej praxi pre svoju nízku cenu.
Prvým spôsobom je redukcia nitrozlúčenín. Reakciu, pri ktorej vzniká anilín, pomenoval vedec Zinin a prvýkrát sa uskutočnila v polovici devätnásteho storočia. Druhým spôsobom je redukcia amidov pomocou lítiumalumíniumhydridu. Primárne amíny možno tiež získať z nitrilov. Treťou možnosťou sú alkylačné reakcie, to znamená zavedenie alkylových skupín do molekúl amoniaku.
Aplikácia amínov

Samotné, vo forme čistých látok, sa amíny používajú len zriedka. Jedným zo vzácnych príkladov je polyetylénpolyamín (PEPA), ktorý v domácich podmienkach uľahčuje vytvrdzovanie epoxidovej živice. Primárny, terciárny alebo sekundárny amín je v podstate medziproduktom pri výrobe rôznych organických látok. Najpopulárnejší je anilín. Je základom veľkej palety anilínových farbív. Farba, ktorú nakoniec získate, závisí priamo od vybranej suroviny. Čistý anilín vytvára modrú farbu, ale zmes anilínu, orto- a para-toluidínu bude červená.
Alifatické amíny sú potrebné na výrobu polyamidov, ako je nylon a iné Používajú sa v strojárstve, ako aj pri výrobe lán, tkanín a fólií. Okrem toho sa pri výrobe polyuretánov používajú alifatické diizokyanáty. Pre svoje výnimočné vlastnosti (ľahkosť, pevnosť, pružnosť a schopnosť priľnúť k akémukoľvek povrchu) sú žiadané v stavebníctve (pena, lepidlo) a v obuvníckom priemysle (protišmykové podrážky).
Medicína je ďalšou oblasťou, kde sa používajú amíny. Chémia pomáha syntetizovať antibiotiká zo skupiny sulfónamidov, ktoré sa úspešne používajú ako lieky druhej línie, to znamená rezervné. V prípade, že si baktérie vyvinú rezistenciu na základné lieky.
Škodlivé účinky na ľudský organizmus
Je známe, že amíny sú veľmi toxické látky. Akákoľvek interakcia s nimi môže spôsobiť poškodenie zdravia: vdýchnutie výparov, kontakt s otvorenou pokožkou alebo požitie zlúčenín do tela. Smrť nastáva v dôsledku nedostatku kyslíka, pretože amíny (najmä anilín) sa viažu na hemoglobín v krvi a bránia mu zachytávať molekuly kyslíka. Alarmujúce príznaky sú dýchavičnosť, modré sfarbenie nasolabiálneho trojuholníka a končekov prstov, tachypnoe (zrýchlené dýchanie), tachykardia, strata vedomia.
Ak sa tieto látky dostanú na holé oblasti tela, musíte ich rýchlo odstrániť vatou predtým namočenou v alkohole. Toto sa musí vykonať čo najopatrnejšie, aby sa nezväčšila oblasť kontaminácie. Ak sa objavia príznaky otravy, určite by ste sa mali poradiť s lekárom.
Alifatické amíny sú jedom pre nervový a kardiovaskulárny systém. Môžu spôsobiť depresiu funkcie pečene, dystrofiu pečene a dokonca rakovinu močového mechúra.