เอมีน
การจำแนกประเภทและการตั้งชื่อ
เอมีนเป็นอนุพันธ์อินทรีย์ของแอมโมเนียในโมเลกุลที่อะตอมไฮโดรเจนหนึ่ง สอง หรือสามอะตอมถูกแทนที่ด้วยอนุมูล บนพื้นฐานนี้พวกเขาแยกแยะได้ หลัก (รเอ็นเอช 2) รอง (ร 2 NH) และ ระดับอุดมศึกษา (ร 3 น) เอมีน
เอมีนสามารถอิ่มตัวหรืออะโรมาติกได้ขึ้นอยู่กับลักษณะของอนุมูลอิสระเช่นเดียวกับอะโรมาติกอิ่มตัว (เมทิลลามีน, อะนิลีนและเมทิลอะนิลีนตามลำดับ) อนุมูลที่มีกิ่งก้านยังสามารถเชื่อมโยงกับอะตอมไนโตรเจนได้ (ตัวอย่างเช่น ถูบิวทิลามีน) และโพลีคอนเดนเสท ดังตัวอย่างจากอะดามันทิลามีน (อะมิโนอะมิโนอะดาแมนเทน) ซึ่งมีผลทางชีวภาพและใช้ในการแพทย์


ตามหลักการของการตั้งชื่อแบบเหตุผล ชื่อของสารประเภทนี้ประกอบด้วยชื่อของอนุมูลที่อะตอมไนโตรเจนเรียกว่า เอมีนในชื่อของเอมีนปฐมภูมิตามระบบการตั้งชื่อสากล อะตอมไนโตรเจนของเอมีนจะได้รับชื่อนี้ เพื่อน-แต่,ใช้โดยระบุตำแหน่งก่อนชื่อโซ่ไฮโดรคาร์บอน อย่างไรก็ตาม เอมีนจำนวนมากยังคงใช้ชื่อที่ไม่สำคัญ เช่น สวรรค์".
นอกเหนือจากหมู่อะมิโนแล้ว โมเลกุลของสารอินทรีย์อาจมีองค์ประกอบทดแทนอื่น ๆ ดังเช่นในกรณีของกรดซัลฟานิลิก อะตอมไนโตรเจนเอมีนสามารถรวมอยู่ในวงแหวนอิ่มตัวได้เช่นกัน ในบรรดาเฮเทอโรไซคลิกเอมีนที่อิ่มตัวนั้นมีโครงสร้างสามส่วนที่สร้างขึ้นด้วยความตึงเครียด เอทิลีนมีน,มีผลกระทบต่อการกลายพันธุ์ที่รุนแรง วงแหวนเอทิลีนไอมีนเป็นส่วนหนึ่งของโมเลกุลของยาบางชนิด วงแหวนเตตระไฮโดรไพร์โรลและพิเพอริดีนที่มีอยู่ในโมเลกุลของอัลคาลอยด์จำนวนหนึ่ง (รวมถึงนิโคตินและอะนาบาซีน ดูหัวข้อที่ 20.4) ถูกสร้างขึ้นโดยไม่มีแรงตึง ด้วยการมีส่วนร่วมเช่นเดียวกับความช่วยเหลือของวงแหวนมอร์โฟลีนทำให้โมเลกุลของยาหลายชนิดถูกสร้างขึ้น




เฮเทอโรไซคลิกอะโรมาติกเอมีน ตัวอย่างเช่น ไพร์โรลและไพริดีน สุดท้ายนี้ หมู่อะมิโนยังสามารถเชื่อมโยงกับเฮเทอโรไซเคิลได้ ดังตัวอย่างที่เห็นได้จากตัวอย่างของอะดีนีน (6-อะมิโนพูริน) ซึ่งเป็นชิ้นส่วนสำคัญของกรดนิวคลีอิก


อนุพันธ์ของแอมโมเนียยังรวมถึงสารอินทรีย์ที่สามารถสร้างได้จากเกลือแอมโมเนียมหรือไฮดรอกไซด์ของมันโดยการแทนที่อะตอมไฮโดรเจนทั้งสี่อะตอมด้วยอนุมูลไฮโดรคาร์บอนต่างๆ ดังที่เห็นได้ในตัวอย่างของเตตระเมทิลแอมโมเนียมไฮดรอกไซด์:

อีกตัวอย่างหนึ่งของอนุพันธ์แอมโมเนียมทดแทนเตตระ - เบสควอเทอร์นารีแอมโมเนียมหรือเกลือของพวกมัน - คือ นิวริน,สารพิษที่เกิดขึ้นระหว่างการสลายตัวของเนื้อเยื่อสัตว์
อะตอมไนโตรเจนควอเทอร์นารีสามารถเป็นส่วนหนึ่งของเฮเทอโรไซเคิลได้ตัวอย่างเช่นเกลือที่เกี่ยวข้องจากซีรีย์ไพริดีน - เกลือ N-alkylpyridinium เกลือควอเทอร์นารีดังกล่าวมีอัลคาลอยด์บางชนิดด้วย นอกจากนี้อะตอมไนโตรเจนควอเทอร์นารียังพบได้ในสารยาหลายชนิดและสารชีวโมเลกุลบางชนิด
ตัวอย่างข้างต้นแสดงให้เห็นถึงความหลากหลายของสารประกอบอะมิโนและความสำคัญทางการแพทย์และทางชีวภาพที่ดี จำเป็นต้องเพิ่มเติมอีกว่าหมู่อะมิโนเป็นส่วนหนึ่งของชีวโมเลกุลประเภทต่างๆ เช่น กรดอะมิโนและโปรตีน กรดนิวคลีอิก และมีอยู่ในอนุพันธ์ของคาร์โบไฮเดรตธรรมชาติจำนวนหนึ่งที่เรียกว่าน้ำตาลอะมิโน หมู่อะมิโนเป็นกลุ่มอัลคาลอยด์ที่ทำหน้าที่ที่สำคัญที่สุดและยาหลายชนิดเพื่อวัตถุประสงค์ต่างๆ ตัวอย่างของสารดังกล่าวจะมีดังต่อไปนี้
24.3.2. เอมีนเป็นเบสอินทรีย์

 การมีไนโตรเจนคู่อิเล็กตรอนอิสระทำให้เอมีนมีคุณสมบัติเป็นเบส ดังนั้น คุณลักษณะเฉพาะของเอมีนคือการทำปฏิกิริยากับกรดเพื่อสร้างเกลือแอมโมเนียมที่สอดคล้องกัน ดังที่เห็นได้จากปฏิกิริยาของเอมีนอิ่มตัวปฐมภูมิ:
การมีไนโตรเจนคู่อิเล็กตรอนอิสระทำให้เอมีนมีคุณสมบัติเป็นเบส ดังนั้น คุณลักษณะเฉพาะของเอมีนคือการทำปฏิกิริยากับกรดเพื่อสร้างเกลือแอมโมเนียมที่สอดคล้องกัน ดังที่เห็นได้จากปฏิกิริยาของเอมีนอิ่มตัวปฐมภูมิ:
ในทำนองเดียวกัน อะนิลีนถูกสร้างขึ้นจากสวรรค์ เกลือไพริดิเนียมถูกสร้างขึ้นจากไพริดีน เป็นต้น เช่นเดียวกับแอมโมเนีย เอมีนในสารละลายที่เป็นน้ำจะสร้างสภาพแวดล้อมที่เป็นด่าง ตามสมการ:
ในเชิงปริมาณความเป็นพื้นฐานของฐานที่ประกอบด้วยไนโตรเจนในสภาพแวดล้อมทางน้ำจะสะท้อนให้เห็นโดยค่าของค่าคงที่สมดุล (ถึง ข ) (บ่อยครั้งที่พวกเขาใช้ค่า อาร์เค ข ) yl/С а (ВН +) ซึ่งแสดงลักษณะความเป็นกรดของกรดคอนจูเกตของเบสที่กำหนด

ฐานที่แข็งแกร่งที่สุดจะเป็นสารประกอบที่มีอะตอมไนโตรเจนซึ่งมีไนโตรเจนคู่โดดเดี่ยวอยู่ในวงโคจรลูกผสม 5p 3 เดียว (อะลิฟาติกเอมีน, แอมโมเนีย, กรดอะมิโน) และฐานที่อ่อนแอที่สุดคือฐานที่คู่นี้เกี่ยวข้องกับ p ,n การผันคำกริยา ( เอไมด์, ไพโรล, ไพริดีน)
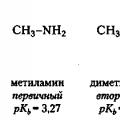
องค์ประกอบทดแทนที่ให้อิเล็กตรอน ซึ่งรวมถึงหมู่อัลคิล ควรเพิ่มความเป็นพื้นฐานของเอมีน เนื่องจากจะเพิ่มความหนาแน่นของอิเล็กตรอนที่อะตอมไนโตรเจน ใช่ เมทิลลามีน (พีเค ข = 3.27) เป็นเบสที่แรงกว่าแอมโมเนีย (พีเค ข = 4.75) และไดเมทิลเอมีน (พีเค ข = 3.02) เป็นเบสที่แข็งแรงกว่าเมทิลลามีน อย่างไรก็ตามเมื่อย้ายไปที่ trimethylamine ตรงกันข้ามกับที่คาดหวังพื้นฐานจะลดลงเล็กน้อย (พีเค ข = 4.10) เหตุผลก็คือเมื่อจำนวนองค์ประกอบทดแทนในอะตอมไนโตรเจนเพิ่มขึ้น การเข้าใกล้ของโปรตอนก็จะยากขึ้นเรื่อยๆ ดังนั้นที่นี่เรากำลังพูดถึงไม่เกี่ยวกับอิเล็กทรอนิกส์ แต่เกี่ยวกับอิทธิพลเชิงพื้นที่ขององค์ประกอบย่อย ผลของสารทดแทนนี้เรียกว่า สเตอริคปัจจัย.
อะโรมาติกเอมีนเป็นเบสที่อ่อนกว่าเบสอิ่มตัวเนื่องจากผลของการดึงอิเล็กตรอนของวงแหวนอะโรมาติก ดังนั้นพื้นฐานของไพริดีนจึงต่ำเช่นกัน การสะสมขององค์ประกอบทดแทนฟีนิลยับยั้งการทำงานของคู่อิเล็กตรอนของอะตอมไนโตรเจนอย่างเห็นได้ชัด ดังนั้น, อาร์เคไดฟีนิลามีนคือ 13.12 และไตรฟีนิลามีนไม่แสดงคุณสมบัติของเบสเลย
ค่าพื้นฐานที่ต่ำมากของไพร์โรลเกิดจากความจริงที่ว่าในโมเลกุลของมันคู่อิเล็กตรอนของอะตอมไนโตรเจนมีส่วนเกี่ยวข้องในการก่อตัวของพันธะอะโรมาติกบี - อิเล็กตรอน การเกาะติดกับโปรตอนต้องใช้พลังงานเพิ่มขึ้นอย่างมาก อันเป็นผลมาจากการก่อตัวของเกลือไพโรเลียม พันธะอะโรมาติก และส่งผลให้ความเสถียรของโมเลกุลหายไป สิ่งนี้อธิบายความจริงที่ว่าไพร์โรลกลายเป็นเรซินอย่างรวดเร็วในสภาพแวดล้อมที่เป็นกรด
เป็นที่น่าสนใจที่จะทราบว่าผลกระทบจากการดึงอิเล็กตรอนอย่างแรงซึ่งกระทำโดยวงแหวนไพร์โรลบนอะตอมไนโตรเจน ส่งผลให้พันธะ N-H อ่อนตัวลง เนื่องจากไพร์โรลสามารถแสดงคุณสมบัติของกรดอ่อนได้ (พีเค ก = 17,5).
![]()
ภายใต้อิทธิพลของโลหะที่มีฤทธิ์เช่นโพแทสเซียมสามารถเตรียมเกลือโพแทสเซียมไพร์โรล - โพแทสเซียมได้
คุณสมบัติที่เป็นกรดของพันธะ N-H ของวงแหวนไพร์โรลอธิบาย โดยเฉพาะอย่างยิ่งความสามารถของพอร์ฟินและอนุพันธ์ตามธรรมชาติในการสร้างเกลือด้วยไอออนบวกของโลหะ วงแหวนไพร์โรลสองวงของโมเลกุลพอร์ไฟรินประสานกับไอออนบวกเนื่องจากคู่อิเล็กตรอนของอะตอมไนโตรเจน และอีกสองวงแหวนประสานกันโดยการแทนที่อะตอมไฮโดรเจน เช่นเดียวกับโมเลกุลไพร์โรลในระหว่างการก่อตัวของไพร์โรล-โพแทสเซียม เกลือเหล่านี้คือคลอโรฟิลล์และเฮโมโกลบิน

เอมีนถูกแบ่งออกเป็นตามลักษณะของสารทดแทนไฮโดรคาร์บอน
ลักษณะโครงสร้างทั่วไปของเอมีน
เช่นเดียวกับในโมเลกุลแอมโมเนีย ในโมเลกุลของเอมีนใดๆ อะตอมไนโตรเจนจะมีคู่อิเล็กตรอนตัวเดียวพุ่งตรงไปที่จุดยอดจุดหนึ่งของจัตุรมุขที่บิดเบี้ยว:
ด้วยเหตุนี้ เอมีน เช่น แอมโมเนีย จึงแสดงคุณสมบัติพื้นฐานอย่างมีนัยสำคัญ
ดังนั้นเอมีนซึ่งคล้ายกับแอมโมเนียจะทำปฏิกิริยากับน้ำแบบย้อนกลับได้ทำให้เกิดเบสที่อ่อนแอ:
พันธะระหว่างไฮโดรเจนไอออนบวกกับอะตอมไนโตรเจนในโมเลกุลเอมีนเกิดขึ้นได้โดยใช้กลไกของผู้บริจาคและตัวรับเนื่องจากอะตอมไนโตรเจนมีอิเล็กตรอนคู่เดียว เอมีนอิ่มตัวนั้นมีเบสที่แข็งแกร่งกว่าเมื่อเทียบกับแอมโมเนียเพราะว่า ในเอมีนดังกล่าว สารทดแทนไฮโดรคาร์บอนมีผลอุปนัยเชิงบวก (+I) ในเรื่องนี้ความหนาแน่นของอิเล็กตรอนในอะตอมไนโตรเจนเพิ่มขึ้นซึ่งเอื้อต่อปฏิกิริยากับ H + ไอออนบวก
อะโรมาติกเอมีน หากหมู่อะมิโนเชื่อมต่อโดยตรงกับวงแหวนอะโรมาติก ก็จะแสดงคุณสมบัติพื้นฐานที่อ่อนแอกว่าเมื่อเปรียบเทียบกับแอมโมเนีย นี่เป็นเพราะความจริงที่ว่าคู่อิเล็กตรอนเดี่ยวของอะตอมไนโตรเจนถูกเลื่อนไปทางระบบอะโรมาติก π ของวงแหวนเบนซีน ซึ่งส่งผลให้ความหนาแน่นของอิเล็กตรอนในอะตอมไนโตรเจนลดลง ส่งผลให้คุณสมบัติพื้นฐานลดลง โดยเฉพาะความสามารถในการโต้ตอบกับน้ำ ตัวอย่างเช่นสวรรค์ทำปฏิกิริยากับกรดแก่เท่านั้น แต่ในทางปฏิบัติแล้วจะไม่ทำปฏิกิริยากับน้ำ
คุณสมบัติทางเคมีของเอมีนอิ่มตัว
ดังที่ได้กล่าวไปแล้ว เอมีนทำปฏิกิริยากับน้ำแบบผันกลับได้:
สารละลายเอมีนที่เป็นน้ำมีปฏิกิริยาอัลคาไลน์เนื่องจากการแตกตัวของฐานที่เกิดขึ้น:
เอมีนอิ่มตัวทำปฏิกิริยากับน้ำได้ดีกว่าแอมโมเนียเนื่องจากมีคุณสมบัติพื้นฐานที่แข็งแกร่งกว่า
คุณสมบัติพื้นฐานของเอมีนอิ่มตัวเพิ่มขึ้นในซีรีส์นี้
เอมีนอิ่มตัวทุติยภูมินั้นมีเบสที่แข็งแกร่งกว่าเอมีนอิ่มตัวปฐมภูมิ ซึ่งในทางกลับกันก็มีเบสที่แข็งแกร่งกว่าแอมโมเนีย สำหรับคุณสมบัติพื้นฐานของเอมีนระดับอุดมศึกษาหากเรากำลังพูดถึงปฏิกิริยาในสารละลายที่เป็นน้ำคุณสมบัติพื้นฐานของเอมีนระดับอุดมศึกษาจะแสดงออกมาแย่กว่าเอมีนทุติยภูมิมากและแย่กว่าคุณสมบัติหลักเล็กน้อยด้วยซ้ำ นี่เป็นเพราะอุปสรรคแบบ steric ซึ่งส่งผลกระทบอย่างมีนัยสำคัญต่ออัตราการโปรตอนของเอมีน กล่าวอีกนัยหนึ่งองค์ประกอบทดแทนสามตัว "ปิดกั้น" อะตอมไนโตรเจนและรบกวนการทำงานของมันกับ H + แคตไอออน
ปฏิกิริยากับกรด
เอมีนอิ่มตัวอิสระและสารละลายในน้ำทำปฏิกิริยากับกรด ในกรณีนี้จะเกิดเกลือ:
เนื่องจากคุณสมบัติพื้นฐานของเอมีนอิ่มตัวนั้นเด่นชัดกว่าแอมโมเนีย เอมีนดังกล่าวจึงทำปฏิกิริยาได้แม้กับกรดอ่อน เช่น กรดคาร์บอนิก:
เกลือเอมีนเป็นของแข็งที่ละลายน้ำได้สูง และละลายได้ไม่ดีในตัวทำละลายอินทรีย์ที่ไม่มีขั้ว ปฏิกิริยาระหว่างเกลือเอมีนกับด่างทำให้เกิดการปลดปล่อยเอมีนอิสระ ซึ่งคล้ายกับการแทนที่ของแอมโมเนียเมื่ออัลคาไลทำปฏิกิริยากับเกลือแอมโมเนียม:
2. เอมีนอิ่มตัวปฐมภูมิทำปฏิกิริยากับกรดไนตรัสเพื่อสร้างแอลกอฮอล์ ไนโตรเจน N2 และน้ำที่สอดคล้องกัน ตัวอย่างเช่น:
คุณลักษณะเฉพาะของปฏิกิริยานี้คือการก่อตัวของก๊าซไนโตรเจน ดังนั้นจึงมีคุณภาพสำหรับเอมีนปฐมภูมิและใช้เพื่อแยกความแตกต่างจากเอมีนทุติยภูมิและตติยภูมิ ควรสังเกตว่าส่วนใหญ่มักเกิดปฏิกิริยานี้โดยการผสมเอมีนไม่ใช่กับสารละลายของกรดไนตรัสเอง แต่ด้วยสารละลายเกลือของกรดไนตรัส (ไนไตรท์) จากนั้นจึงเติมกรดแร่เข้มข้นลงในส่วนผสมนี้ เมื่อไนไตรต์ทำปฏิกิริยากับกรดแร่เข้มข้น จะเกิดกรดไนตรัสขึ้น ซึ่งต่อมาจะทำปฏิกิริยากับเอมีน:
เอมีนทุติยภูมิภายใต้สภาวะที่คล้ายคลึงกันจะให้ของเหลวที่มีน้ำมัน ซึ่งเรียกว่า N-ไนโตรซามีน แต่ปฏิกิริยานี้ไม่เกิดขึ้นในการทดสอบการใช้งานจริงในวิชาเคมี เอมีนระดับอุดมศึกษาไม่ทำปฏิกิริยากับกรดไนตรัส
การเผาไหม้เอมีนโดยสมบูรณ์ทำให้เกิดคาร์บอนไดออกไซด์ น้ำ และไนโตรเจน:
ปฏิสัมพันธ์กับฮาโลอัลเคน
เป็นที่น่าสังเกตว่าเกลือชนิดเดียวกันนั้นได้มาจากการกระทำของไฮโดรเจนคลอไรด์กับเอมีนที่ถูกแทนที่มากกว่า ในกรณีของเรา เมื่อไฮโดรเจนคลอไรด์ทำปฏิกิริยากับไดเมทิลลามีน:
การเตรียมเอมีน:
1) อัลคิเลชันของแอมโมเนียด้วยฮาโลอัลเคน:
ในกรณีที่ขาดแอมโมเนียจะได้รับเกลือแทนเอมีน:
2) การรีดิวซ์ด้วยโลหะ (เป็นไฮโดรเจนในชุดกิจกรรม) ในสภาพแวดล้อมที่เป็นกรด:
ตามด้วยการบำบัดสารละลายด้วยอัลคาไลเพื่อปล่อยเอมีนอิสระ:
3) ปฏิกิริยาของแอมโมเนียกับแอลกอฮอล์เมื่อผ่านส่วนผสมผ่านอะลูมิเนียมออกไซด์ที่ให้ความร้อน ขึ้นอยู่กับสัดส่วนของแอลกอฮอล์/เอมีน เอมีนปฐมภูมิ ทุติยภูมิ หรือตติยภูมิจะเกิดขึ้น:
คุณสมบัติทางเคมีของสวรรค์
สวรรค์ - ชื่อเล็กๆ น้อยๆ ของอะมิโนเบนซีน มีสูตรดังนี้
ดังที่เห็นได้จากภาพประกอบ ในโมเลกุลอะนิลีน หมู่อะมิโนเชื่อมต่อโดยตรงกับวงแหวนอะโรมาติก เอมีนดังที่ได้กล่าวไปแล้วมีคุณสมบัติพื้นฐานที่เด่นชัดน้อยกว่าแอมโมเนียมาก ดังนั้นโดยเฉพาะอย่างยิ่งสวรรค์จึงไม่ทำปฏิกิริยากับน้ำและกรดอ่อนเช่นกรดคาร์บอนิก
ปฏิกิริยาของอะนิลีนกับกรด
สวรรค์ทำปฏิกิริยากับกรดอนินทรีย์ที่มีความแรงปานกลางและแรง ในกรณีนี้เกลือฟีนิลแอมโมเนียมจะเกิดขึ้น:
ปฏิกิริยาของสวรรค์กับฮาโลเจน
ดังที่ได้กล่าวไว้แล้วในตอนต้นของบทนี้ หมู่อะมิโนในอะโรมาติกเอมีนถูกดึงเข้าไปในวงแหวนอะโรมาติก ซึ่งจะลดความหนาแน่นของอิเล็กตรอนในอะตอมไนโตรเจน และเป็นผลให้เพิ่มขึ้นในวงแหวนอะโรมาติก ความหนาแน่นของอิเล็กตรอนที่เพิ่มขึ้นในวงแหวนอะโรมาติกนำไปสู่ความจริงที่ว่าปฏิกิริยาการแทนที่อิเล็กโทรฟิลิก โดยเฉพาะอย่างยิ่งปฏิกิริยากับฮาโลเจน ดำเนินไปได้ง่ายขึ้นมาก โดยเฉพาะในตำแหน่งออร์โธและพาราที่สัมพันธ์กับหมู่อะมิโน ดังนั้นสวรรค์จึงทำปฏิกิริยากับน้ำโบรมีนได้ง่าย ทำให้เกิดตะกอนสีขาวเป็น 2,4,6-ไตรโบรโมอะนิลีน:
ปฏิกิริยานี้เป็นปฏิกิริยาเชิงคุณภาพสำหรับอะนิลีน และมักจะทำให้สามารถระบุได้ในหมู่สารประกอบอินทรีย์อื่นๆ
ปฏิกิริยาของสวรรค์กับกรดไนตรัส
อะนิลีนทำปฏิกิริยากับกรดไนตรัส แต่เนื่องจากความจำเพาะและความซับซ้อนของปฏิกิริยานี้ จึงไม่ปรากฏในการสอบ Unified State จริงในวิชาเคมี
ปฏิกิริยาอะนิลีนอัลคิเลชัน
การใช้อัลคิเลชั่นตามลำดับของอะนิลีนที่อะตอมไนโตรเจนกับไฮโดรคาร์บอนฮาโลเจนสามารถได้รับเอมีนทุติยภูมิและตติยภูมิ:
คุณสมบัติทางเคมีของกรดอะมิโน
กรดอะมิโน เป็นสารประกอบที่โมเลกุลประกอบด้วยหมู่ฟังก์ชันสองประเภท - หมู่อะมิโน (-NH 2) และหมู่คาร์บอกซี- (-COOH)
กล่าวอีกนัยหนึ่งกรดอะมิโนถือได้ว่าเป็นอนุพันธ์ของกรดคาร์บอกซิลิกในโมเลกุลที่อะตอมไฮโดรเจนหนึ่งอะตอมหรือมากกว่าถูกแทนที่ด้วยกลุ่มอะมิโน
ดังนั้นสูตรทั่วไปของกรดอะมิโนจึงสามารถเขียนได้เป็น (NH 2) x R(COOH) y โดยที่ x และ y มักจะเท่ากับหนึ่งหรือสอง
เนื่องจากโมเลกุลของกรดอะมิโนมีทั้งหมู่อะมิโนและหมู่คาร์บอกซิล จึงแสดงคุณสมบัติทางเคมีคล้ายกับทั้งเอมีนและกรดคาร์บอกซิลิก
คุณสมบัติที่เป็นกรดของกรดอะมิโน
การก่อตัวของเกลือด้วยอัลคาไลและคาร์บอเนตของโลหะอัลคาไล
เอสเทอริฟิเคชันของกรดอะมิโน
กรดอะมิโนสามารถทำปฏิกิริยากับเอสเทอริฟิเคชันกับแอลกอฮอล์ได้:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
คุณสมบัติพื้นฐานของกรดอะมิโน
1. การก่อตัวของเกลือเมื่อทำปฏิกิริยากับกรด
NH 2 CH 2 COOH + HCl → + Cl —
2. ปฏิกิริยากับกรดไนตรัส
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
หมายเหตุ: การทำปฏิกิริยากับกรดไนตรัสจะเกิดขึ้นในลักษณะเดียวกับเอมีนปฐมภูมิ
3. อัลคิเลชั่น
NH 2 CH 2 COOH + CH 3 I → + ฉัน —
4. ปฏิกิริยาระหว่างกรดอะมิโนซึ่งกันและกัน
กรดอะมิโนสามารถทำปฏิกิริยาซึ่งกันและกันเพื่อสร้างเปปไทด์ ซึ่งเป็นสารประกอบที่มีพันธะเปปไทด์ –C(O)-NH- ในโมเลกุลของพวกมัน
ในเวลาเดียวกัน ควรสังเกตว่าในกรณีของปฏิกิริยาระหว่างกรดอะมิโนสองตัวที่แตกต่างกัน โดยไม่ปฏิบัติตามเงื่อนไขการสังเคราะห์เฉพาะบางประการ การก่อตัวของไดเปปไทด์ที่แตกต่างกันจะเกิดขึ้นพร้อมกัน ตัวอย่างเช่น แทนที่จะเกิดปฏิกิริยาของไกลซีนกับอะลานีนข้างต้น ซึ่งนำไปสู่ไกลไซลานานีน ปฏิกิริยาที่นำไปสู่อะลานิลไกลซีนสามารถเกิดขึ้นได้:
นอกจากนี้โมเลกุลไกลซีนไม่จำเป็นต้องทำปฏิกิริยากับโมเลกุลอะลานีน ปฏิกิริยาเปปไทเซชันยังเกิดขึ้นระหว่างโมเลกุลของไกลซีน:
และอะลานีน:
นอกจากนี้ เนื่องจากโมเลกุลของเปปไทด์ที่เกิดขึ้น เช่น โมเลกุลกรดอะมิโนดั้งเดิม มีหมู่อะมิโนและหมู่คาร์บอกซิล เปปไทด์เองก็สามารถทำปฏิกิริยากับกรดอะมิโนและเปปไทด์อื่นๆ ได้เนื่องจากการก่อตัวของพันธะเปปไทด์ใหม่
กรดอะมิโนแต่ละตัวถูกใช้เพื่อผลิตโพลีเปปไทด์สังเคราะห์หรือที่เรียกว่าเส้นใยโพลีเอไมด์ ดังนั้น โดยเฉพาะอย่างยิ่งการใช้โพลีคอนเดนเซชันของกรด 6-aminohexane (ε-aminocaproic) ไนลอนจึงถูกสังเคราะห์ขึ้นในอุตสาหกรรม:
ผลเรซินไนลอนที่ได้จะถูกนำมาใช้เพื่อผลิตเส้นใยสิ่งทอและพลาสติก
การก่อตัวของเกลือภายในของกรดอะมิโนในสารละลายที่เป็นน้ำ
ในสารละลายที่เป็นน้ำ กรดอะมิโนมีอยู่เป็นส่วนใหญ่ในรูปของเกลือภายใน - ไอออนไบโพลาร์ (สวิตเตอร์ไอออน)
เอมีนใด ๆ มีอิเล็กตรอนคู่เดียวในอะตอมไนโตรเจน เมื่อเอมีนลงไปในน้ำ โปรตอนจากน้ำสามารถสร้างพันธะโควาเลนต์ใหม่กับอะตอมไนโตรเจนผ่านกลไกผู้บริจาคและตัวรับ ดังนั้นจึงทำให้เกิดไอออนอัลคิลหรือเอริลแอมโมเนียม น้ำที่สูญเสียโปรตอนจะกลายเป็นไฮดรอกไซด์ไอออน สภาพแวดล้อมกลายเป็นด่าง เอมีนจึงเป็นเบส ความแข็งแรงของฐานเหล่านี้ขึ้นอยู่กับธรรมชาติและจำนวนอนุมูลที่เกี่ยวข้องกับไนโตรเจน อนุมูลอะลิฟาติก เช่น เมทิล เอทิล ฯลฯ ที่มีคุณสมบัติในการบริจาคอิเล็กตรอน จะเพิ่มความเป็นพื้นฐานของเอมีน ในทางกลับกัน อนุมูลอะโรมาติก เนื่องจากการแยกส่วนของอิเล็กตรอนคู่หนึ่งบนวงแหวนเบนซีน ทำให้ความเป็นพื้นฐานลดลงอย่างมาก ในแง่ของทฤษฎีการสั่นพ้องของ Linus Pauling ดูเหมือนว่า:
อย่างที่คุณเห็น มีอิเล็กตรอนคู่เดียวอยู่บนอะตอมไนโตรเจนในโครงสร้างเรโซแนนซ์โครงสร้างใดโครงสร้างหนึ่งเท่านั้น (รูปแบบมีโซเมอร์) ในอีกสามโครงสร้างไบโพลาร์อื่น ๆ ตรงกันข้ามจะมี "+" บนอะตอมไนโตรเจนซึ่งเป็นประจุที่ป้องกันการโปรตอนตามธรรมชาติ นี่คือสาเหตุที่ทำให้พื้นฐานลดลงอย่างมาก มีจำหน่ายใน โอ-และ ป-ตำแหน่งของประจุลบช่วยให้เราสามารถตั้งสมมติฐานเกี่ยวกับความง่ายของปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกที่เกิดขึ้นอย่างแม่นยำในตำแหน่งเหล่านี้ โดยที่อนุภาคที่โจมตีเป็นไอออนบวก (ตัวอย่างเช่น
![]() ) ด้านล่างนี้เป็นตัวอย่างของปฏิกิริยาประเภทนี้กับอะโรมาติกเอมีน
) ด้านล่างนี้เป็นตัวอย่างของปฏิกิริยาประเภทนี้กับอะโรมาติกเอมีน
ในเชิงปริมาณความแข็งแกร่งของฐานนั้นมีลักษณะเป็นค่า K ข หรือลอการิทึมลบ พีเค ข . ดัชนี “b” หมายความว่าเรากำลังพูดถึงค่าคงที่สมดุลระหว่างเบสซึ่งก็คือเอมีนกับกรดคอนจูเกตของมัน ซึ่งก็คือแอมโมเนียมไอออน:
ตามคำนิยาม ปฏิกิริยาที่ผันกลับได้ดังกล่าวอธิบายโดยการแสดงออกเชิงวิเคราะห์:

เนื่องจากความเข้มข้นของน้ำในสารละลายน้ำเจือจางมีค่าคงที่ในทางปฏิบัติและเท่ากับ 55.5 นางสาวจากนั้นจะรวมอยู่ในค่าคงที่สมดุล "ใหม่":

การคูณตัวเศษและส่วนของด้านขวาของสมการด้วย [H + ] และคำนึงว่า [H + ] [OH - ] = K w = 10 -14 เราได้รับ:

ลอการิทึมนิพจน์เชิงวิเคราะห์นี้โดยใช้ลอการิทึมทศนิยม
เรามาถึงสมการ:

การเปลี่ยนเครื่องหมายไปในทางตรงกันข้ามและแนะนำสัญกรณ์ที่ยอมรับโดยทั่วไป: - lg = p เราได้รับ:

เนื่องจากลอการิทึมของเอกภาพในฐานใดๆ มีค่าเท่ากับศูนย์ และ 14 คือ pH = pOH จึงเห็นได้ชัดว่า pK b สอดคล้องกับค่าของความเข้มข้นของไฮดรอกซิลไอออน โดยที่แอมโมเนียมไอออนบวกครึ่งหนึ่งจะไปพร้อมกับการกำจัด a โปรตอนกลายเป็นเอมีนอิสระ ค่า pK b ของเบสมีความหมายเหมือนกับค่า pK ของกรด ด้านล่างนี้เป็นตารางที่ข้อมูลแสดงอิทธิพลของธรรมชาติของอนุมูลและปริมาณที่มีต่อค่าคงที่พื้นฐานของเอมีนต่างๆ
| ชื่อฐาน | สูตรพื้นฐาน | ประเภทฐาน | K b ที่ 25 o C | ค่า pK b ที่ 25 o C |
| แอมโมเนีย | 1,75 10 -5 | 4,75 | ||
| เมทิลเอมีน | หลัก อะลิฟาต | 4,60 10 - 4 | 3,34 | |
| เอทิลามีน | | หลัก อะลิฟาต | 6,50 10 - 4 | 3,19 |
| บิวทิลามีน | หลัก อะลิฟาต | 4,00 10 - 4 | 3,40 | |
| ไอโซบูติเอมีน | | หลัก อะลิฟาต | 2,70 10 - 4 | 3,57 |
| ฉธบ.-บิวทิลามีน | | หลัก อะลิฟาต | 3,60 10 - 4 | 3,44 |
| เทรต-บิวทิลามีน | หลัก อะลิฟาต | 2,80 10 - 4 | 3,55 | |
| เบนซิลามีน | | หลัก อะลิฟาต | 2,10 10 -5 | 4,67 |
| ไดเมทิลลามีน | รอง อะลิฟาต | 5,40 10 -4 | 3,27 | |
| ไดเอทิลเอมีน | รอง อะลิฟาต | 1,20 10 - 3 | 2,91 | |
| ไตรเมทิลามีน | ระดับอุดมศึกษา อะลิฟาต | 6,50 10 -5 | 4,19 | |
| ไตรเอทิลเอมีน | | ระดับอุดมศึกษา อะลิฟาต | 1,00 10 - 3 | 3,00 |
| สวรรค์ | หลัก กลิ่นหอม | 4,30 10 - 10 | 9,37 | |
| ป-โทลูอิดีน | | หลัก กลิ่นหอม | 1,32 10 -9 | 8,88 |
| ป-ไนโตรอะนิลีน | | หลัก กลิ่นหอม | 1,00 10 - 13 | 13,0 |
| N,N-ไดเมทิลอะนิลีน | ระดับอุดมศึกษา มีกลิ่นหอมของไขมัน | 1,40 10 -9 | 8,85 | |
| ไดฟีนิลามีน | รอง กลิ่นหอม | 6,20 10 -14 | 13,21 | |
| ไพริดีน | เฮเทอโรอะโรมาติก | 1,50 10 - 9 | 8,82 | |
| ควิโนลีน | เฮเทอโรอะโรมาติก | 8,70 10 -10 | 9,06 | |
| พิเพอริดีน | รอง อะลิฟาต และเฮเทอโรไซคลิก | 1,33 10 -3 | 3,88 | |
| ไฮดราซีน | 9,30 10 -7 | 6,03 | ||
| ไฮดรอกซิลามีน | 8,90 10 - 9 | 8,05 | ||
| เอทานอลเอมีน | แยง. อันดับแรก อลิฟ | 1,80 10 - 5 | 4,75 |
ตารางเหล่านี้ช่วยให้เราสามารถสรุปผลได้ดังต่อไปนี้:
1) อะลิฟาติกเอมีนเป็นเบสที่แข็งแกร่งกว่าอะโรมาติกเอมีนมาก (ประมาณ 100,000 - 1,000,000 เท่า)
2) เอมีนเฮเทอโรอะโรมาติกมีความเป็นพื้นฐานใกล้เคียงกับอะโรมาติก
3) ความเป็นพื้นฐานของอะโรมาติกเอมีนได้รับอิทธิพลอย่างมากจากองค์ประกอบทดแทนที่อยู่ใน คู่- ตำแหน่งให้กับกลุ่มอะมิโน สารทดแทนที่บริจาคอิเล็กตรอนจะช่วยเพิ่มความเป็นพื้นฐานของเอมีน ในขณะที่สารทดแทนที่ถอนอิเล็กตรอนจะลดค่าดังกล่าวลงอย่างรวดเร็ว อัตราส่วนพื้นฐานของอะโรมาติกเอมีนที่มีกลุ่มเมทิลและไนโตรในตำแหน่งที่ระบุคือประมาณ 10,000: 1
4) อะลิฟาติกเอมีนทุติยภูมินั้นมีพื้นฐานมากกว่าเอมีนหลักเล็กน้อย ในขณะที่อะลิฟาติกเอมีนในระดับตติยภูมิมีความเป็นพื้นฐานในระดับเดียวกัน
5) ลักษณะของอนุมูลในเอมีนปฐมภูมิไม่ส่งผลกระทบอย่างมีนัยสำคัญต่อความเป็นพื้นฐานของเอมีน
6) เฮเทอโรไซคลิกเอมีนอิ่มตัวมีความเป็นพื้นฐานที่ระดับอะลิฟาติกเอมีนทุติยภูมิ
7) อะโรมาติกเอมีนที่มีไขมันมีความพื้นฐานอยู่ที่ระดับอะโรมาติกเอมีน
8) อะโรมาติกเอมีนทุติยภูมิมีความเป็นพื้นฐานน้อยกว่าเอมีนปฐมภูมิประมาณ 10,000 เท่า
9) อะตอมอิเล็กโทรเนกาติตีที่จับกันในโมเลกุลกับอะตอมไนโตรเจนของกลุ่มอะมิโนจะลดความเป็นเบสลง 10 (ไนโตรเจน) และ 1,000 เท่า (ออกซิเจน)
10) อะตอมออกซิเจนที่แยกออกจากหมู่อะมิโนด้วยกลุ่มเมทิลีนสองกลุ่มจะลดความเป็นพื้นฐานของมันลงเพียง 67 เท่า
ควรสังเกตว่าความเป็นพื้นฐานของกรดเอไมด์เนื่องจากผลการถอนอิเล็กตรอนของกลุ่มคาร์บอนิลนั้นต่ำมาก - ต่ำกว่าเอมีนอะโรมาติกทุติยภูมิด้วยซ้ำ: สำหรับอะซิตาไมด์ pK b = 13.52; สำหรับอะซีตานิไลด์ pK b = 13.60 และสำหรับยูเรีย pK b = 13.82
อะซิตาไมด์ อะเซทานิไลด์ ยูเรีย
เหมือนบริเวณ เอมีนปฐมภูมิ ทุติยภูมิ และตติยภูมิตอบสนอง ด้วยกรด:
โพรพิลามีน โพรพิลแอมโมเนียม โบรไมด์
ไดเมทิลลามีน ไดเมทิลแอมโมเนียมซัลเฟต
ไตรเมทิลลามีน ไตรเมทิลแอมโมเนียม เปอร์คลอเรต
ด้วยกรดโพลีบาซิกไม่เพียงแต่สามารถสร้างค่าเฉลี่ยได้เท่านั้น แต่ยังสามารถสร้างได้ และเกลือที่เป็นกรด:
ไดเมทิลลามีน ไดเมทิลแอมโมเนียม ไฮโดรเจนซัลเฟต
เมทิลไอโซบิวทิลเอมีน เมทิลไอโซบิวทิลแลมโมเนียม ไดไฮโดรเจน ออร์โธฟอสเฟต
อะโรเมติกส์เบื้องต้น, และ เอมีนอะโรมาติกไขมันทุติยภูมิและตติยภูมิด้วยสารละลายน้ำเจือจางของกรดแก่ก็ให้เช่นกัน เกลือ:


พวกมันยังสามารถขึ้นรูปได้ เกลือภายใต้อิทธิพล กรดแก่เข้มข้นแต่ที่ เจือจางด้วยน้ำเกลือเหล่านี้ ไฮโดรไลซ์ให้พื้นฐานที่อ่อนแอนั่นคือ เอมีนผู้ปกครอง:

เหมือนรากฐานที่อ่อนแอมาก อย่าให้เกลือทั้งที่มีกรดไฮโดรคลอริกหรือกรดซัลฟิวริกเข้มข้น จริงอยู่ triphenylamine ยังคงผลิตเปอร์คลอเรตด้วยกรดเปอร์คลอริก:

.
เอมีนอะลิฟาติกปฐมภูมิตอบสนองในสองขั้นตอน: ในระยะแรกรุนแรงมาก ไม่เสถียรในน้ำแม้ในขณะที่เย็นลง เกลือไดโซเนียมซึ่งในขั้นที่ 2 ทำปฏิกิริยากับน้ำจนเกิดเป็น แอลกอฮอล์:
โพรพิลามีน โพรพิลไดอาโซเนียม คลอไรด์
โพรพานอล-1
ในปฏิกิริยาของเอมีนปฐมภูมิกับโซเดียมไนไตรท์และกรดไฮโดรคลอริก ก๊าซออก(มองเห็นฟองอากาศได้ชัดเจน) และ กลิ่นคาวการเปลี่ยนแปลงของเอมีน ถึงแอลกอฮอล์เป็นปฏิกิริยาเชิงคุณภาพต่อเอมีนอะลิฟาติกปฐมภูมิ
หากเราสรุปปฏิกิริยาทั้งสองข้างต้น เราจะได้:
เอมีนทุติยภูมิทำปฏิกิริยาแตกต่างไปจากเดิมอย่างสิ้นเชิง: ภายใต้อิทธิพลของโซเดียมไนไตรท์และกรดไฮโดรคลอริก N-ไนโตรซามีน- การเชื่อมต่อมีความเสถียรมากแม้ในขณะที่ถูกความร้อน:
เมทิลเอทิลเอมีน N-ไนโตรโซเมทิลเอไทเอมีน
ในปฏิกิริยาของอะลิฟาติกเอมีนทุติยภูมิกับโซเดียมไนไตรท์และกรดไฮโดรคลอริก การก่อตัวของน้ำมันสีเหลืองละลายในน้ำได้ไม่ดีและมีกลิ่นอันไม่พึงประสงค์อย่างยิ่งเป็นปฏิกิริยาเชิงคุณภาพต่ออะลิฟาติกเอมีนทุติยภูมิ
ไนโตรซามีน - สารก่อมะเร็ง: ไม่ว่าสถานที่และวิธีการเข้าสู่ร่างกายของสัตว์ทดลองจะทำให้เกิดมะเร็งตับหรือไม่ก็ตาม ใช้กันอย่างแพร่หลายในการทดลองด้านเนื้องอกวิทยา พวกมันทำหน้าที่ตอบสนอง นั่นคือผ่านทางผิวหนัง
เอมีนอะลิฟาติกระดับตติยภูมิทำปฏิกิริยาจากส่วนผสมของโซเดียมไนไตรท์และกรดไฮโดรคลอริก ด้วยกรดเท่านั้น:
ไม่มีผลกระทบที่มองเห็นได้ในปฏิกิริยานี้ กลิ่นอ่อนลง
เอมีนอะโรมาติกปฐมภูมิทำปฏิกิริยากับรูปแบบค่อนข้างคงที่ที่อุณหภูมิ 0 ถึง 5 o C เกลือไดโซเนียม- ปฏิกิริยานี้ตีพิมพ์ครั้งแรกในปี พ.ศ. 2401 ในวารสารเคมีของเยอรมันโดย Peter Griess และมีชื่อของเขาว่า:
ปฏิกิริยา Griess เกี่ยวข้องกับอะนิลีนจำนวนมากที่มีองค์ประกอบทดแทนอัลคิล โอ-,ม- และ ป-ตำแหน่งในกลุ่มอะมิโน:
นอกจากนี้มันยังรวมถึงอนุพันธ์อะนิลีนซึ่งประกอบด้วยองค์ประกอบย่อยที่ถอนอิเล็กตรอน, องค์ประกอบทดแทนที่ให้อิเล็กตรอน และองค์ประกอบแทนที่ของกลุ่มพิเศษ ตัวอย่างเช่น:
ด้วยกรดไฮโดรโบรมิกปฏิกิริยาจะเร็วขึ้น แต่ไม่ค่อยได้ใช้และเฉพาะในห้องปฏิบัติการเท่านั้นเนื่องจากมีต้นทุนสูงและขาดแคลนกรดนี้
ในการผลิตเกลือไดอาโซเนียมพวกเขาจะใช้ในขั้นตอนการสังเคราะห์ต่อไปนี้ทันที แต่ในห้องปฏิบัติการมักถูกแยกออกโดยปฏิกิริยาการแลกเปลี่ยนกับสารละลายโซเดียมเตตระฟลูออโรบอเรตอิ่มตัว:

เกลือไดอาโซเนียมมักใช้เพื่อให้ได้สีย้อมเอโซจำนวนมากโดยการเชื่อมต่อเอโซกับฟีนอล (แนฟทอล) และเอมีนตติยภูมิอะโรมาติก เช่น:


สีย้อมอะโซที่ได้จะเป็นตัวบ่งชี้ค่า pH: ในสภาพแวดล้อมที่เป็นกรดเนื่องจากการก่อตัวของพันธะไฮโดรเจนมันมีโครงสร้างเรียบซึ่งผลการบริจาคอิเล็กตรอนของกลุ่มไฮดรอกซิลอ่อนลง - แบบฟอร์มนี้มีสีเหลือง ในกลุ่มอัลคาไลน์ โปรตอนจะถูกแยกออกจากกลุ่มไฮดรอกซิล และมี "ฟีโนเลตไอออน" ปรากฏขึ้น ซึ่งเป็นองค์ประกอบทดแทน ED ที่แข็งแกร่งที่สุด และสีจะเปลี่ยนเป็นสีส้มแดง:

บทบาทของโซดาในปฏิกิริยาอะโซคัปปลิ้งคือการจับตัวของกรดไฮโดรคลอริก (หรือกรดเข้มข้นอื่น ๆ ) ที่เกิดขึ้นกับเกลือของกรด - โซเดียมไบคาร์บอเนต:
ส่วนผสมของโซเดียมคาร์บอเนตและโซเดียมไบคาร์บอเนตเป็นสารละลายบัฟเฟอร์ที่สร้างสภาพแวดล้อมที่เป็นด่างเล็กน้อย
สำหรับเอมีนอะโรมาติกระดับตติยภูมิ การมีเพศสัมพันธ์เอโซจะต้องเกิดขึ้นในสภาพแวดล้อมที่เป็นกรดเล็กน้อย ซึ่งมั่นใจได้โดยการเติมเกลือที่ไฮโดรไลซ์ที่ไอออน เช่น โซเดียมอะซิเตต ในสภาพแวดล้อมที่เป็นกรดสูง เอมีนจะผลิตเกลือแอมโมเนียม ซึ่งไอออนบวกไม่ทำปฏิกิริยากับไดอะโซเนียมไอออนตามธรรมชาติ


โซเดียมอะซิเตตทำปฏิกิริยาทันทีกับกรดไฮโดรคลอริกที่เกิดขึ้น ผลลัพธ์ที่ได้คือสารละลายบัฟเฟอร์ที่ประกอบด้วยกรดอะซิติกอ่อนและโซเดียมอะซิเตตส่วนเกิน ให้สภาพแวดล้อมที่เป็นกรดเล็กน้อย:
เอมีนอะโรมาติกทุติยภูมิตอบสนอง ด้วยโซเดียมไนไตรท์และกรดไฮโดรคลอริกด้วยการศึกษา N-ไนโตรซามีนตัวอย่างเช่น N-methylaniline ให้ N-nitroso-N-methylaniline ซึ่งเป็นน้ำมันสีเหลืองที่มีกลิ่นอันไม่พึงประสงค์อย่างมาก ซึ่งจะแข็งตัวที่ 13 °C:
อะโรมาติก N-ไนโตรโซเอมีนเช่นเดียวกับอะลิฟาติกเป็นสารก่อมะเร็ง นอกจากนี้ยังก่อให้เกิดมะเร็งตับและยังใช้ในการทดลองด้านเนื้องอกวิทยาอีกด้วย
อะโรมาติก N-ไนโตรโซเอมีนภายใต้อิทธิพลของไฮโดรเจนคลอโรหรือโบรไมด์แห้ง หรือภายใต้อิทธิพลของกรดซัลฟิวริกเข้มข้น ได้รับการจัดเรียงใหม่ ตีพิมพ์ครั้งแรกในปี 1886 ในวารสารเคมีของเยอรมันโดย O. Fischer และ E. Hepp ภายใต้เงื่อนไขเหล่านี้ หมู่ไนโตรโซจะถูกถ่ายโอนแบบเลือกสรรไป ป-ตำแหน่ง:
4-nitroso-N-methylaniline ที่ได้รับจากการจัดเรียงใหม่มีคุณสมบัติทางกายภาพและกิจกรรมทางชีวภาพที่แตกต่างกันโดยสิ้นเชิง เป็นของแข็งสีเขียวที่มีจุดหลอมเหลว 113 °C โดยเรืองแสงในสารละลายในตัวทำละลายอินทรีย์ ไม่เป็นสารก่อมะเร็งแม้ว่าจะทำให้เกิดโรคผิวหนังก็ตาม
เอมีนอะโรมาติกระดับตติยภูมิตอบสนอง ด้วยโซเดียมไนไตรท์และกรดไฮโดรคลอริกการให้ สารประกอบ C-ไนโตรโซ- กลุ่มไนโตรโซถูกคัดเลือกมุ่งไปที่ ป-ตำแหน่ง:
สารประกอบ C-ไนโตรโซสามารถรีดิวซ์ได้ง่ายด้วยไฮโดรเจนบนนิกเกิลเรนีย์ สิ่งนี้ทำให้เกิดไดอัลคิลไดเอมีนที่ไม่สมมาตร ตัวอย่างเช่น:
เกลือของอะลิฟาติกและอะโรมาติกเอมีนสามารถเปลี่ยนกลับเป็นเอมีนได้อย่างง่ายดายโดยการกระทำของด่าง ตัวอย่างเช่น:
โพรพิลแอมโมเนียม เปอร์คลอเรต โพรพิลามีน
เมทิลโพรพิลโมเนียม ไฮโดรเจนซัลเฟต เมทิลโพรพิลามีน

เบสควอเตอร์นารีแอมโมเนียมในทางกลับกันก็สามารถแปลเป็นได้ เกลือแอมโมเนียมควอเทอร์นารีการกระทำ กรด:
ไดเมทิลเอทิลไอโซโพรพิลแอมโมเนียมไฮดรอกไซด์ ไดเมทิลเอทิลไอโซโพรพิลแอมโมเนียมคลอไรด์
อย่างที่คุณเห็นนี่เป็นปฏิกิริยาทั่วไปของการทำให้ด่างเป็นกลางด้วยกรด - จะได้รับเกลือและน้ำ
ในหน้า 19 ของคู่มือนี้ แนะนำว่าปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกเกิดขึ้นได้ง่ายในอะโรมาติกเอมีนใน ออร์โธ- และ คู่-ตำแหน่งของวงแหวนเบนซีน อันที่จริง อะนิลีนสามารถเกิดโบรมีนได้ง่ายในทุกตำแหน่งเหล่านี้ในคราวเดียว:

N,N-ไดอัลคิลานิลีนถูกซัลโฟเนต, ไนเตรต และไดอะโซไทซ์เป็น ออร์โธ- และ คู่-ตำแหน่ง:




โซเดียมอะซิเตตแปลงกรดเชิงซ้อนแก่ให้เป็นกรดอ่อน: กรดอะซิติก:
การใช้เอมีน
เอมีนปฐมภูมิที่ง่ายที่สุดคือ เมทิลลามีนใช้ในการสังเคราะห์ยาฆ่าแมลง สารฆ่าเชื้อรา สารเร่งการวัลคาไนซ์ สารลดแรงตึงผิว ยา สีย้อม เชื้อเพลิงจรวด และตัวทำละลาย ตัวอย่างเช่น N-methyl-2-pyrrolidone ซึ่งเป็นตัวทำละลายยอดนิยมสำหรับเคลือบเงาและสีย้อมบางชนิดได้มาจากการทำปฏิกิริยาเมทิลลามีนกับγ-butyrolactone (cyclic ester ของกรด 4-hydroxybutanoic):

γ-บิวทิโรเลต N-เมทิล-2-ไพร์โรลิโดน
เอมีนทุติยภูมิที่ง่ายที่สุดคือ ไดเมทิลลามีนใช้ในการสังเคราะห์ยาฆ่าแมลง สารกำจัดวัชพืช สารเร่งการวัลคาไนซ์ สารลดแรงตึงผิว ยาหลายชนิด สีย้อม และตัวทำละลายที่สำคัญ เช่น ไดเมทิลโฟเรียไมด์ (DMF) ไดเมทิลอะเซทาไมด์ (DMAA) และเฮกซาเมทิลฟอสโฟโรไตรเอไมด์ (HMPTA) หรือเฮกซาเมธาพอล DMF ผลิตขึ้นทางอุตสาหกรรม เช่น โดยการทำปฏิกิริยาไดเมทิลลามีนกับกรดฟอร์มิกเมทิลเอสเตอร์:
เมทิลรูปแบบไดเมทิลเอมีน DMF เมทานอล
DMAA ผลิตขึ้นทางอุตสาหกรรมโดยทำปฏิกิริยาไดเมทิลลามีนกับอะซิติกแอนไฮไดรด์:
อะซิติกแอนไฮไดรด์ DMAA
การสังเคราะห์ทางอุตสาหกรรมของเฮกซาเมธาพอลเกี่ยวข้องกับปฏิกิริยาของไดเมทิลลามีนกับฟอสฟอรัสออกซีคลอไรด์:

ฟอสฟอรัสไตรคลอไรด์ HMPTA
เอมีนระดับอุดมศึกษาที่ง่ายที่สุดคือ ไตรเมทิลามีนใช้ในการสังเคราะห์เบสควอเทอร์นารีแอมโมเนียม สารลอยตัว สารหน่วง วัตถุเจือปนอาหาร ตัวอย่างเช่นขั้นตอนสุดท้ายของการสังเคราะห์ carbacholine ซึ่งเป็นยาที่ใช้ในการรักษาโรคต้อหินและ atony ในลำไส้หรือกระเพาะปัสสาวะหลังผ่าตัดเกี่ยวข้องกับการทำงานร่วมกันของ trimethylamine กับอนุพันธ์ของ carbamoyl ของเอทิลีนคลอโรไฮดริน:
คาร์บาโคลีน
สารลดแรงตึงผิวประจุบวกจะได้รับในทำนองเดียวกัน:
ไตรเมทิลอัลคิลแอมโมเนียมคลอไรด์
เอทิลามีนใช้ในการผลิตสีย้อม สารลดแรงตึงผิว สารกำจัดวัชพืช ตัวอย่างเช่น ซิมาซีน ซึ่งเป็นสารกำจัดวัชพืชสำหรับปกป้องข้าวโพดและผักจากวัชพืช ได้มาจากการทำปฏิกิริยาเอทิลลามีนกับปริมาณไซยานูริกคลอไรด์ที่คำนวณได้ในสภาพแวดล้อมที่เป็นด่าง:
คลอโรไซยานูร์ ซิมาซีน
ไดเอทิลเอมีนใช้ในการผลิตสีย้อม ยาฆ่าแมลง สารเร่งการวัลคาไนเซชันของยาง สารยับยั้งการกัดกร่อน ยารักษาโรค และสารไล่ ตัวอย่างเช่น DEET ยากันยุงที่รู้จักกันดีนั้นได้มาจากปฏิกิริยา:

กรดคลอไรด์ ม-กรดโทลูอิก N,N-ไดเอทิล- ม-โทลูเอไมด์
ไอโซโพรพิลามีน, บิวทิลามีน, ไอโซบิวทิลามีน, อ-บูติเอมีนและ เติร์ต-บิวทิลามีนใช้ในอุตสาหกรรมที่คล้ายคลึงกัน
1,6-เฮกเซนไดเอมีนใช้กันอย่างแพร่หลายในการสังเคราะห์ไนลอนโดยปฏิกิริยาโพลีคอนเดนเซชันกับกรด 1,4-butanedicarboxylic (adipic):

ในบรรดายาหลายชนิดมีกลุ่มอะมิโนหลายประเภท ตัวอย่างเช่น ยาทั้งหมด 1,308 รายการอยู่ในหนังสืออ้างอิงของ MD Mashkovsky อย่างน้อย 70 รายการเป็นเอมีนหลัก อย่างน้อย 52 รายการเป็นรอง และอย่างน้อย 108 รายการเป็นระดับตติยภูมิ นอกจากนี้ในบรรดายายังมีเกลือควอเทอร์นารีแอมโมเนียม 41 ตัวและกรดคาร์บอกซิลิกมากกว่า 70 เอไมด์, กรดอะริลซัลโฟนิก 26 เอไมด์และอนุพันธ์ของกรดออร์โธฟอสฟอริก 12 เอไมด์ นอกจากนี้ยังมีเอไมด์แบบไซคลิก - แลคแทม มี 5 ชื่อ. อนุพันธ์ของกรดอะมิโนธรรมชาติ – 14 ชื่อ ด้านล่างนี้เป็นตัวอย่างของยาที่มีกลุ่มฟังก์ชันที่ระบุไว้:
แอนเนสเตซิน– เอทิลอีเทอร์ ป-กรดอะมิโนเบนโซอิก เป็นเอมีนอะโรมาติกหลักและเอสเทอร์ในเวลาเดียวกัน

มีฤทธิ์ชาเฉพาะที่ ใช้เพื่อบรรเทาอาการปวดบาดแผลและแผล การอาเจียนระหว่างตั้งครรภ์ และสำหรับโรคทางทะเลและทางอากาศ
แบคโคลเฟน– 4-อะมิโน-3-( ป-คลอโร)กรดฟีนิลบิวทาโนอิก เป็นอะลิฟาติกเอมีนปฐมภูมิ เอสเทอร์ และอนุพันธ์ของฮาโลเจนของซีรีย์เบนซีนในเวลาเดียวกัน

ลดความตึงเครียดของกล้ามเนื้อและมีฤทธิ์ระงับปวด ใช้สำหรับโรคปลอกประสาทเสื่อมแข็ง (Multiple Sclerosis)
ซัลบูทามอล – 2-ถู-บิวทิลอะมิโน-1-(4"-ไฮดรอกซี-3"-ไฮดรอกซีเมทิล)ฟีนิลเอธานอล เป็นอะลิฟาติกเอมีนรอง แอลกอฮอล์รองและปฐมภูมิและฟีนอลในเวลาเดียวกัน

มีฤทธิ์ขยายหลอดลมและป้องกันการหดตัวก่อนวัยอันควรในหญิงตั้งครรภ์ ใช้สำหรับโรคหอบหืดและในการปฏิบัติทางสูติกรรม
ออร์โทเฟน– เกลือโซเดียมของกรด 2-(2",6"-ไดคลอโร)ฟีนิลอะมิโนฟีนิลอะซีติก เป็นอะโรมาติกเอมีนรอง เกลือของกรดคาร์บอกซิลิก และอนุพันธ์ของฮาโลเจนของซีรีย์เบนซีนในเวลาเดียวกัน

มีฤทธิ์ต้านการอักเสบยาแก้ปวดและลดไข้ ใช้สำหรับโรคไขข้ออักเสบเฉียบพลัน, โรคข้ออักเสบรูมาตอยด์, โรคกระดูกสันหลังอักเสบยึดติด, โรคข้ออักเสบ, โรคข้อกระดูกสันหลังเสื่อม
ไอโซเวอรีน– เอ็น-ไอโซเอมิล-1,5-เพนเทนไดเอมีน ไดไฮโดรคลอไรด์ เป็นเกลือไดแอมโมเนียมของเอมีนปฐมภูมิและทุติยภูมิในเวลาเดียวกัน

ลดความดันโลหิต เพิ่มเสียง และช่วยให้กล้ามเนื้อมดลูกหดตัว ใช้เป็นตัวเร่งการคลอดและกระตุ้นการหดตัวของมดลูกในระยะหลังคลอด
เมทิลีนสีน้ำเงิน– N,N,N’,N’-เตตระเมทิลไทโอนีน คลอไรด์ เป็นทั้งเอมีนอะโรมาติกไขมันระดับอุดมศึกษาและเกลือแอมโมเนียมของเอมีนชนิดเดียวกัน นอกจากนี้ยังมีวงแหวนเฮเทอโรอะโรมาติกที่มีอะตอมไนโตรเจน "ไพริดีน"

ใช้ภายนอกเป็นน้ำยาฆ่าเชื้อสำหรับแผลไหม้ pyoderma และรูขุมขน สำหรับโรคกระเพาะปัสสาวะอักเสบและท่อปัสสาวะอักเสบ โพรงจะถูกล้างด้วยสารละลายสีน้ำเงิน 0.02%
เพนทามิน– 3-เมทิล-1,5-บิส-(N,N-ไดเมทิล-N-เอทิล)แอมโมเนียม-3-อะซาเพนเทน ไดโบรไมด์ เป็นทั้งอะลิฟาติกเอมีนระดับตติยภูมิและเกลือแอมโมเนียมควอเทอร์นารีสองเท่าของเอมีนเดียวกัน

มีฤทธิ์ในการปิดกั้นปมประสาท ใช้สำหรับวิกฤตความดันโลหิตสูง การหดเกร็งของหลอดเลือดส่วนปลาย การหดเกร็งของลำไส้และทางเดินน้ำดี อาการจุกเสียดของไต เพื่อบรรเทาอาการเฉียบพลันของโรคหอบหืดในหลอดลม และอาการบวมน้ำที่ปอดและสมอง
นิโคตินาไมด์– กรด 3-ไพริดีนคาร์บอกซิลิก เอไมด์ มันเป็นเอไมด์ของกรดคาร์บอกซิลิกและเป็นอนุพันธ์ของวงแหวนเฮเทอโรอะโรมาติกที่มีไนโตรเจน - ไพริดีน

มีคุณสมบัติต่อต้านเพลลากริก ปรับปรุงการเผาผลาญคาร์โบไฮเดรต และมีผลเชิงบวกต่อโรคเบาหวาน โรคตับและหัวใจ แผลในกระเพาะอาหารและลำไส้เล็กส่วนต้นในรูปแบบที่ไม่รุนแรง ใช้สำหรับโรคกระเพาะที่มีความเป็นกรดต่ำ, โรคตับอักเสบเฉียบพลันและเรื้อรัง, โรคตับแข็ง, สำหรับการกระตุกของหลอดเลือดในแขนขา, ไตและสมอง
ซัลฟาไดเมซิน – 2-(ป-อะมิโนเบนซีนซัลฟามิโด)-4,6-ไดเมทิลไพริมิดีน เป็นตัวแทนของยาซัลโฟนาไมด์กลุ่มใหญ่ เป็นทั้งซัลฟานิลาไมด์ ซึ่งเป็นอะโรมาติกเอมีนปฐมภูมิและเป็นอนุพันธ์ของวงแหวนเฮเทอโรอะโรมาติกที่มีไนโตรเจน - ไพริมิดีน

เช่นเดียวกับยาทั้งหมดในกลุ่มนี้ sulfadimezin เป็นสารต้านจุลชีพที่ออกฤทธิ์ ใช้สำหรับโรคปอดบวม สเตรปโตคอคคัส การติดเชื้อไข้กาฬหลังแอ่น ภาวะติดเชื้อในกระแสเลือด โรคหนองใน รวมถึงการติดเชื้อที่เกิดจากเชื้ออีโคไลและจุลินทรีย์อื่น ๆ
โฟปูรีน – 6-ไดเอทิลเอนามิโดฟอสฟามิโด-2-ไดเมทิลอะมิโน-7-เมทิลพิวรีน พร้อมกันนี้เป็นทริปเปิ้ลฟอสฟาไมด์ เอมีนอะโรมาติกระดับตติยภูมิ และอนุพันธ์ของจักรยานเฮเทอโรอะโรมาติกที่มีไนโตรเจน - พิวรีน
เฮโมเดซ– สารละลายเกลือน้ำ 6% ของโพลีไวนิลไพโรลิโดนน้ำหนักโมเลกุลต่ำ หน่วยพื้นฐานของโพลีเมอร์ประกอบด้วยวงแหวนแลกแทม

ผูกสารพิษที่ไหลเวียนอยู่ในเลือดและกำจัดสารพิษเหล่านั้นผ่านทางสิ่งกีดขวางไตอย่างรวดเร็ว ใช้สำหรับโรคบิด อาการอาหารไม่ย่อย โรคซัลโมเนลโลซิส และโรคไหม้ในระยะมึนเมา
ฮิสติดีน– L-β-imidazolylalanine หรือ L-α-amino-β-(4-imidazolyl)propionic acid มันเป็นกรดα-อะมิโนและเป็นอนุพันธ์ของวงแหวนเฮเทอโรอะโรมาติกที่มีไนโตรเจน - อิมิดาโซล

ฮิสติดีนเป็นกรดอะมิโนที่จำเป็น พบในอวัยวะต่างๆ เป็นส่วนหนึ่งของคาร์โนซีน ซึ่งเป็นสารสกัดไนโตรเจนในกล้ามเนื้อ ในร่างกายจะเกิดดีคาร์บอกซิเลชันพร้อมกับการก่อตัวของฮีสตามีน ซึ่งเป็นหนึ่งในปัจจัยทางเคมี (ตัวกลาง) ที่เกี่ยวข้องกับการควบคุมการทำงานที่สำคัญ
แอนจิโอเทนซินาไมด์– L-แอสพาราจินิล-L-อาร์จินิล-L-valyl-L-tyrosinyl-L-valyl-L-histidinyl acetate – L-โพรลิล-L-ฟีนิลอะลานีน เป็นเกลือของกรดอะซิติกของ octapeptide ที่ประกอบด้วยกรดα-amino ตามธรรมชาติ

ในภาวะช็อก ใช้สำหรับการหดตัวของหลอดเลือดในอวัยวะภายใน ผิวหนัง และไตอย่างรวดเร็วและรุนแรง แอนจิโอเทนซินาไมด์ยังมีความสามารถในการหดตัวของกล้ามเนื้อเรียบของมดลูก ลำไส้ กระเพาะปัสสาวะ และถุงน้ำดี ช่วยกระตุ้นการปล่อยอะดรีนาลีนจากต่อมหมวกไตและการผลิตอัลโดสเตอโรน
| เอมีน คำนิยาม | |
| การจำแนกประเภทของเอมีนตามจำนวนอะตอมไฮโดรเจนในแอมโมเนียที่ถูกแทนที่ด้วยอนุมูล | |
| การจำแนกประเภทของเอมีนตามลักษณะของอนุมูลที่เกี่ยวข้องกับอะตอมไนโตรเจน | |
| ไอโซเมอริซึมและการตั้งชื่อของอะลิฟาติกเอมีน | |
| วิธีการผลิตเอมีน | |
| การเตรียมเอมีนจากสารประกอบที่มีไนโตรเจนอื่นๆ | |
| จากสารประกอบไนโตร | |
| จากสารประกอบไนโตรโซ | |
| จากออกซิมส์ | |
| จากไฮดราโซน | |
| จากเอไมด์ของกรดคาร์บอกซิลิก | |
| จากไนไตรล์ของกรดคาร์บอกซิลิก: 7 | |
| การเตรียมเอมีนจากสารประกอบประเภทอื่น | |
| จากอัลดีไฮด์และคีโตนโดยปฏิกิริยา Leuckart-Wallach | |
| การเตรียมอะลิฟาติกเอมีนปฐมภูมิโดยแอมโมเนียอัลคิเลชัน | |
| การเตรียมอะลิฟาติกเอมีนทุติยภูมิโดยอัลคิเลชั่นของปฐมภูมิ | |
| การเตรียมอะลิฟาติกเอมีนระดับตติยภูมิโดยอัลคิเลชั่นของสารทุติยภูมิ | |
| การเตรียมเกลือควอเทอร์นารีแอมโมเนียมจากเอมีนตติยภูมิ | |
| การเตรียมเบสควอเทอร์นารีแอมโมเนียมจากเกลือควอเทอร์นารีแอมโมเนียม | |
| เทอร์โมไลซิสของเบสควอเทอร์นารีแอมโมเนียม | |
| อัลคิเลชันของอะโรมาติกเอมีนปฐมภูมิให้สมมาตร | |
| เอมีนระดับอุดมศึกษา | |
| การสังเคราะห์เอมีนอะโรมาติกไขมันทุติยภูมิสี่ขั้นตอน | |
| การเตรียมเอมีนปฐมภูมิบริสุทธิ์ตามเกเบรียล | |
| การเตรียมเอมีนจากแอลกอฮอล์ | |
| การเตรียมอะโรมาติกเอมีน | |
| การลดสารประกอบอะโรมาติกไนโตรตาม N.N. ซินิน่า | |
| การลดสารประกอบอะโรมาติกไนโตรตาม Bechamp | |
| การลดตัวเร่งปฏิกิริยาของสารประกอบอะโรมาติกไนโตรด้วยไฮโดรเจน | |
| คุณสมบัติทางกายภาพของอะลิฟาติกเอมีน | |
| สถานะทางกายภาพของอะลิฟาติกเอมีน | |
| การขึ้นอยู่กับจุดเดือดของอะลิฟาติกเอมีนบนโครงสร้าง | |
| ความสามารถในการละลายของอะลิฟาติกเอมีนในน้ำและตัวทำละลายอินทรีย์ | |
| คุณสมบัติทางกายภาพของอะโรมาติกเอมีน | |
| สถานะทางกายภาพและการละลายของอะโรมาติกเอมีน | |
| คุณสมบัติทางเคมีของเอมีน | |
| ความสัมพันธ์ระหว่างโครงสร้างอิเล็กทรอนิกส์ของเอมีนกับความเป็นเบส | |
| ค่าคงที่พื้นฐานและค่า pK b สำหรับเอมีนอะลิฟาติก อะโรมาติก และเฮเทอโรไซคลิก และสารประกอบบางชนิดที่เกี่ยวข้อง | |
| ปฏิกิริยาของเอมีนกับกรด | |
| ปฏิกิริยาระหว่างเอมีนกับโซเดียมไนไตรท์และกรดไฮโดรคลอริก | |
| การแปลงอะลิฟาติกเอมีนปฐมภูมิเป็นแอลกอฮอล์ผ่านสารประกอบไดโซ | |
| การแปลงอะลิฟาติกเอมีนทุติยภูมิเป็นสารประกอบ N-ไนโตรโซ | |
| การก่อมะเร็งของอะลิฟาติก N-ไนโตรซามีน | |
| ปฏิกิริยาระหว่างเอมีนอะลิฟาติกระดับตติยภูมิกับโซเดียมไนไตรท์ | |
| และกรดไฮโดรคลอริก | |
| การเปลี่ยนอะโรมาติกเอมีนปฐมภูมิเป็นเกลือไดโซเนียม | |
| การแยกเกลือไดอาโซเนียมออกจากสารละลายในรูปของเตตราฟลูออโรบอเรต | |
| ปฏิกิริยาการมีเพศสัมพันธ์ Azose กับฟีนอล (แนฟทอล) | |
| สีย้อม Azo เป็นตัวบ่งชี้ค่า pH | |
| ปฏิกิริยาเชื่อมต่อ Azo กับเอมีนอะโรมาติกระดับตติยภูมิ | |
| การแปลงเอมีนอะโรมาติกไขมันทุติยภูมิเป็น N-ไนโตรซามีน | |
| การก่อมะเร็งของ N-nitrosamines ที่เป็นไขมัน | |
| การจัดเรียงใหม่ของ Fischer-Hepp | |
| การแปลงอะโรมาติกเอมีนระดับตติยภูมิเป็นสารประกอบ C-ไนโตรโซ | |
| การลดตัวเร่งปฏิกิริยาของสารประกอบอะโรมาติก C-nitroso ด้วยไฮโดรเจน | |
| ปฏิกิริยาระหว่างเกลือของอะลิฟาติกและอะโรมาติกเอมีนกับด่าง | |
| ปฏิกิริยาระหว่างเบสควอเทอร์นารีแอมโมเนียมกับกรด | |
| ปฏิกิริยาการทดแทนอิเล็กโทรฟิลิกในอะโรมาติกเอมีน | |
| การใช้เอมีน | |
| การใช้เมทิลและไดเมทิลเอมีน | |
| การเตรียมตัวทำละลายอินทรีย์ยอดนิยม: DMF, DMAA และ HMPTA | |
| การใช้ไตรเมทิลและเอทิลเอมีน | |
| การใช้ไดเอทิลเอมีน | |
| การใช้ไดเอมีนเพื่อการผลิตพอลิเอไมด์โพลีเมอร์ | |
| ยารักษาโรค – เอมีนและอนุพันธ์เอมีน | |
| แอนเนสเตซิน | |
| แบคโคลเฟน | |
| ซัลบูทามอล | |
| ออร์โทเฟน | |
| ไอโซเวอรีน | |
| เมทิลีนสีน้ำเงิน | |
| เพนทามิน | |
| นิโคตินาไมด์ | |
| ซัลฟาไดเมซิน | |
| โฟปูรีน | |
| เฮโมเดซ | |
| ฮิสติดีน | |
| แอนจิโอเทนซินาไมด์ | |
| เนื้อหา |
เอมีนเป็นสารประกอบอินทรีย์ประเภทเดียวที่มีพื้นฐานอย่างเห็นได้ชัด อย่างไรก็ตาม เอมีนนั้นเป็นเบสที่อ่อนแอ ตอนนี้การกลับไปที่โต๊ะจะมีประโยชน์ 12-1 เพื่อระลึกถึงคำจำกัดความสามประการของกรดและเบส ตามคำจำกัดความสามประการของความเป็นพื้นฐาน สามารถแยกแยะพฤติกรรมทางเคมีของเอมีนได้สามด้าน
1. เอมีนทำปฏิกิริยากับกรดโดยทำหน้าที่เป็นตัวรับโปรตอน:
ดังนั้นเอมีนจึงเป็นเบสบรอนสเตด 2. เอมีนเป็นผู้บริจาคคู่อิเล็กตรอน (ฐานลูอิส):

3. สารละลายที่เป็นน้ำของเอมีน ดังนั้นเอมีนเมื่อทำปฏิกิริยากับน้ำจึงสามารถสร้างแอนไอออนของไฮดรอกไซด์ได้

ดังนั้นเอมีนจึงเป็นเบสของอาร์เรเนียส แม้ว่าเอมีนทั้งหมดจะเป็นเบสที่อ่อนแอ แต่ความเป็นพื้นฐานของพวกมันนั้นขึ้นอยู่กับธรรมชาติและจำนวนของอนุมูลไฮโดรคาร์บอนที่ติดอยู่กับอะตอมไนโตรเจน อัลคิลเอมีนมีพื้นฐานมากกว่าอะโรมาติกเอมีนมาก ในบรรดาอัลคิลามีน สารพื้นฐานที่สุดคือสารทุติยภูมิ สารปฐมภูมิมีสารพื้นฐานน้อยกว่า รองลงมาคือเอมีนในระดับอุดมศึกษาและแอมโมเนีย โดยทั่วไป พื้นฐานจะลดลงตามลำดับ:
การวัดความเป็นเบสของสารคือค่าคงที่ความเป็นเบส ซึ่งเป็นค่าคงที่สมดุลของอันตรกิริยาระหว่างเอมีนกับน้ำ (ดูคำจำกัดความของความเป็นเบสของ Arrhenius ด้านบน) เนื่องจากมีน้ำในปริมาณมาก ความเข้มข้นของน้ำจึงไม่ปรากฏในการแสดงออกของค่าคงที่พื้นฐาน:

ยิ่งฐานแข็งแรงเท่าไร โปรตอนก็จะยิ่งถูกกำจัดออกจากโมเลกุลของน้ำมากขึ้นเท่านั้น และความเข้มข้นของไฮดรอกไซด์ไอออนในสารละลายก็จะยิ่งสูงขึ้นตามไปด้วย ดังนั้นฐานที่แข็งแกร่งจึงมีลักษณะเฉพาะ
ค่า K ขนาดใหญ่ ค่าสำหรับเอมีนบางชนิดแสดงไว้ด้านล่าง:

ค่าเหล่านี้แสดงให้เห็นถึงความสัมพันธ์ระหว่างความเป็นพื้นฐานของเอมีนและโครงสร้างของพวกมันซึ่งถูกกล่าวถึงข้างต้น. ฐานที่แข็งแกร่งที่สุดคือไดเมทิลลามีนรอง และจุดอ่อนที่สุดคืออะโรมาติกเอมีนอะนิลีน
อะโรมาติกเอมีนเป็นเบสที่อ่อนแอมากเนื่องจากคู่อิเล็กตรอนเดี่ยวของอะตอมไนโตรเจน (ซึ่งเป็นตัวกำหนดคุณสมบัติพื้นฐานของเอมีน) มีปฏิกิริยากับเมฆอิเล็กตรอนของนิวเคลียสอะโรมาติก ดังนั้นจึงเข้าถึงโปรตอนได้น้อย (หรือกรดอื่นๆ) ความเป็นพื้นฐานที่สูงขึ้นของเอมีนทุติยภูมิเมื่อเปรียบเทียบกับเอมีนปฐมภูมิอธิบายได้จากข้อเท็จจริงที่ว่าหมู่อัลคิลเนื่องจากผลการเหนี่ยวนำเชิงบวกของพวกมัน จ่ายอิเล็กตรอนผ่านพันธะไปยังอะตอมไนโตรเจน ซึ่งเอื้อต่อการแบ่งปันคู่อิเล็กตรอนเดี่ยว หมู่อัลคิลสองหมู่ช่วยให้อิเล็กตรอนแก่อะตอมไนโตรเจนได้แรงมากกว่าหนึ่งกลุ่ม ดังนั้นเอมีนทุติยภูมิจึงเป็นเบสที่แรงกว่า จากนี้ใครๆ ก็คาดหวังว่าเอมีนระดับอุดมศึกษาจะมีเบสที่แข็งแกร่งกว่าเบสรองด้วยซ้ำ อย่างไรก็ตาม ข้อสันนิษฐานนี้มีเหตุผลสำหรับเฟสก๊าซเท่านั้น และในสารละลายที่เป็นน้ำ ความเป็นพื้นฐานของเอมีนระดับตติยภูมิไม่สูงมากนัก นี่อาจเป็นเพราะผลของการแก้ปัญหา
เอมีนเป็นเบสอินทรีย์ที่อ่อนแอ ความพื้นฐานถูกกำหนดโดยจำนวนและธรรมชาติขององค์ประกอบทดแทนอินทรีย์ที่เชื่อมต่อกับอะตอมไนโตรเจน การปรากฏตัวของวงแหวนอะโรมาติกจะลดความเป็นพื้นฐานลงอย่างรวดเร็ว (มูลค่าของเอมีน เอมีนรองเป็นเบสที่แข็งแกร่งกว่าเบสหลักและตติยภูมิ
อามินเข้ามาในชีวิตของเราโดยไม่คาดคิด จนกระทั่งเมื่อเร็ว ๆ นี้สิ่งเหล่านี้เป็นสารพิษซึ่งการชนกันอาจทำให้เสียชีวิตได้ และตอนนี้ หนึ่งศตวรรษครึ่งต่อมา เราใช้เส้นใยสังเคราะห์ ผ้า วัสดุก่อสร้าง และสีย้อมที่มีเอมีนเป็นหลัก ไม่ พวกเขาไม่ได้ปลอดภัยขึ้น ผู้คนสามารถ "เชื่อง" พวกเขาและพิชิตพวกเขาได้ โดยได้รับผลประโยชน์บางอย่างสำหรับตนเอง เราจะพูดถึงอันไหนต่อไป
คำนิยาม
สำหรับการพิจารณาคุณภาพและปริมาณของอะนิลีนในสารละลายหรือสารประกอบจะใช้ปฏิกิริยาเมื่อสิ้นสุดการตกตะกอนสีขาวในรูปของ 2,4,6-ไตรโบรโมอะนิลีนตกลงไปที่ด้านล่างของหลอดทดลอง
เอมีนในธรรมชาติ
เอมีนพบได้ทุกที่ในธรรมชาติในรูปของวิตามิน ฮอร์โมน และผลิตภัณฑ์จากการเผาผลาญขั้นกลาง พบได้ทั้งในร่างกายของสัตว์และในพืช นอกจากนี้การสลายตัวของสิ่งมีชีวิตยังก่อให้เกิดเอมีนขนาดกลางซึ่งในสถานะของเหลวจะปล่อยกลิ่นอันไม่พึงประสงค์ของน้ำเกลือจากปลาเฮอริ่ง “พิษจากซากศพ” ที่อธิบายไว้อย่างกว้างขวางในวรรณกรรมปรากฏขึ้นอย่างแม่นยำเนื่องจากมีอำพันของเอมีนที่จำเพาะเจาะจง
เป็นเวลานานแล้วที่สารที่เรากำลังพิจารณาสับสนกับแอมโมเนียเนื่องจากมีกลิ่นคล้ายกัน แต่ในช่วงกลางศตวรรษที่ 19 Wurtz นักเคมีชาวฝรั่งเศสสามารถสังเคราะห์เมทิลลามีนและเอทิลลามีนได้ และพิสูจน์ว่าเมื่อเผาพวกมันจะปล่อยไฮโดรคาร์บอนออกมา นี่คือความแตกต่างพื้นฐานระหว่างสารประกอบดังกล่าวกับแอมโมเนีย
การผลิตเอมีนในสภาวะอุตสาหกรรม
เนื่องจากอะตอมไนโตรเจนในเอมีนมีสถานะออกซิเดชันต่ำที่สุด การลดลงของสารประกอบที่มีไนโตรเจนจึงเป็นวิธีที่ง่ายและเข้าถึงได้มากที่สุดเพื่อให้ได้มา เป็นประเภทนี้ที่ใช้กันอย่างแพร่หลายในการปฏิบัติทางอุตสาหกรรมเนื่องจากมีต้นทุนต่ำ
วิธีแรกคือการลดสารประกอบไนโตร ปฏิกิริยาที่เกิดขึ้นระหว่างสวรรค์นั้นตั้งชื่อโดยนักวิทยาศาสตร์ Zinin และเกิดขึ้นเป็นครั้งแรกในช่วงกลางศตวรรษที่สิบเก้า วิธีที่สองคือการลดเอไมด์โดยใช้ลิเธียมอลูมิเนียมไฮไดรด์ เอมีนปฐมภูมิสามารถกู้คืนได้จากไนไตรล์ ตัวเลือกที่สามคือปฏิกิริยาอัลคิเลชันนั่นคือการนำกลุ่มอัลคิลเข้าสู่โมเลกุลแอมโมเนีย
การใช้เอมีน

ในรูปของสารบริสุทธิ์เองไม่ค่อยมีการใช้เอมีน หนึ่งในตัวอย่างที่หาได้ยากคือโพลีเอทิลีนโพลีเอมีน (PEPA) ซึ่งในสภาพภายในประเทศช่วยให้อีพอกซีเรซินแข็งตัวได้ โดยพื้นฐานแล้วเอมีนปฐมภูมิ ตติยภูมิ หรือทุติยภูมิเป็นผลิตภัณฑ์ขั้นกลางในการผลิตสารอินทรีย์ต่างๆ ความนิยมมากที่สุดคือสวรรค์ มันเป็นพื้นฐานของจานสีย้อมสวรรค์ขนาดใหญ่ สีที่คุณได้รับในตอนท้ายนั้นขึ้นอยู่กับวัตถุดิบที่เลือกโดยตรง อะนิลีนบริสุทธิ์จะให้สีฟ้า แต่ส่วนผสมของอะนิลีน ออร์โธ- และพารา-โทลูอิดีนจะเป็นสีแดง
อะลิฟาติกเอมีนจำเป็นต่อการผลิตโพลีเอไมด์ เช่น ไนลอนและอื่นๆ ใช้ในวิศวกรรมเครื่องกล เช่นเดียวกับในการผลิตเชือก ผ้า และฟิล์ม นอกจากนี้ อะลิฟาติกไดไอโซไซยาเนตยังใช้ในการผลิตโพลียูรีเทนอีกด้วย เนื่องจากคุณสมบัติพิเศษ (ความเบา ความแข็งแรง ความยืดหยุ่น และความสามารถในการยึดติดกับพื้นผิวใดๆ) จึงเป็นที่ต้องการในการก่อสร้าง (โฟม กาว) และในอุตสาหกรรมรองเท้า (พื้นรองเท้ากันลื่น)
ยาเป็นอีกพื้นที่หนึ่งที่ใช้เอมีน เคมีช่วยในการสังเคราะห์ยาปฏิชีวนะจากกลุ่มซัลโฟนาไมด์ซึ่งสามารถใช้เป็นยาทางเลือกที่สองได้สำเร็จนั่นคือยาสำรอง ในกรณีที่แบคทีเรียเกิดความต้านทานต่อยาสำคัญ
ผลร้ายต่อร่างกายมนุษย์
เป็นที่ทราบกันว่าเอมีนเป็นสารที่เป็นพิษมาก การมีปฏิสัมพันธ์กับสิ่งเหล่านี้อาจก่อให้เกิดอันตรายต่อสุขภาพ: การสูดดมไอระเหย, การสัมผัสกับผิวหนังที่เปิดกว้าง, หรือการกลืนสารเข้าสู่ร่างกาย ความตายเกิดจากการขาดออกซิเจน เนื่องจากเอมีน (โดยเฉพาะอะนิลีน) จับกับเฮโมโกลบินในเลือดและป้องกันไม่ให้จับโมเลกุลออกซิเจน อาการที่น่าตกใจ ได้แก่ หายใจถี่, สามเหลี่ยมจมูกและปลายนิ้วเปลี่ยนสีเป็นสีน้ำเงิน, อิศวร (หายใจเร็ว), หัวใจเต้นเร็ว, หมดสติ
หากสารเหล่านี้สัมผัสกับบริเวณที่เปลือยเปล่าของร่างกาย คุณต้องรีบกำจัดออกด้วยสำลีชุบแอลกอฮอล์ก่อนหน้านี้ ต้องทำอย่างระมัดระวังที่สุดเพื่อไม่ให้พื้นที่ปนเปื้อนเพิ่มขึ้น หากมีอาการพิษควรปรึกษาแพทย์อย่างแน่นอน
อะลิฟาติกเอมีนเป็นพิษต่อระบบประสาทและระบบหัวใจและหลอดเลือด สิ่งเหล่านี้สามารถทำให้เกิดภาวะซึมเศร้าในการทำงานของตับ โรคตับเสื่อม และแม้กระทั่งมะเร็งกระเพาะปัสสาวะ