Amines
Pag-uuri at katawagan
Ang mga amine ay mga organikong derivatives ng ammonia, sa molekula kung saan ang isa, dalawa o tatlong hydrogen atoms ay pinalitan ng mga radical. Sa batayan na ito sila ay nakikilala pangunahin (RNH 2), pangalawa (R 2 NH) at tersiyaryo (R 3 N) amines
Depende sa likas na katangian ng radikal, ang mga amin ay maaaring puspos o mabango, pati na rin ang saturated aromatic (methylamine, aniline at methylaniline, ayon sa pagkakabanggit). Ang isang branched radical ay maaari ding iugnay sa isang nitrogen atom (halimbawa, kuskusin butylamine), at polycondensed, tulad ng ipinakita ng halimbawa ng adamantylamine (aminoadamantane), na may biological effect at ginagamit sa medisina


Ayon sa mga prinsipyo ng rational nomenclature, ang pangalan ng klase ng mga sangkap na ito ay binubuo ng pangalan ng mga radical sa nitrogen atom, na tinatawag na amine. Sa mga pangalan ng pangunahing mga amin ayon sa internasyonal na katawagan, ang amine nitrogen atom ay binibigyan ng pangalan ami-pero, ginagamit sa pamamagitan ng pagpahiwatig ng lokasyon nito bago ang pangalan ng hydrocarbon chain. Gayunpaman, maraming amine ang nagpapanatili ng kanilang mga maliit na pangalan, halimbawa, aniline".
Bilang karagdagan sa amino group, ang mga molekula ng mga organikong sangkap ay maaaring maglaman ng iba pang mga substituent, tulad ng, halimbawa, sa kaso ng sulfanilic acid. Ang amine nitrogen atom ay maaari ding isama sa saturated ring. Kabilang sa mga saturated heterocyclic amines ay isang istraktura na may tatlong miyembro na binuo na may pag-igting ethylenimine, pagkakaroon ng malakas na mutagenic effect. Ang ethyleneimine ring ay bahagi ng mga molekula ng ilang gamot. Ang mga singsing na tetrahydropyrrole at piperidine na nasa mga molekula ng isang bilang ng mga alkaloid (kabilang ang nikotina at anabasine, tingnan ang Seksyon 20.4) ay binuo nang walang pag-igting. Sa kanilang pakikilahok, pati na rin sa tulong ng morpholine ring, ang mga molekula ng maraming mga gamot ay itinayo.




Ang heterocyclic aromatic amines ay, halimbawa, pyrrole at pyridine. Sa wakas, ang amino group ay maaari ding iugnay sa isang heterocycle, gaya ng inilalarawan ng halimbawa ng adenine (6-aminopurine), isang mahalagang fragment ng mga nucleic acid.


Kasama rin sa mga derivatives ng ammonia ang mga organikong sangkap na maaaring mabuo mula sa mga ammonium salts o hydroxide nito sa pamamagitan ng pagpapalit ng lahat ng apat na hydrogen atoms ng iba't ibang hydrocarbon radical, tulad ng makikita sa halimbawa ng tetramethylammonium hydroxide:

Ang isa pang halimbawa ng tetra-substituted ammonium derivatives - quaternary ammonium bases o kanilang mga salts - ay neurin, isang nakakalason na sangkap na nabuo sa panahon ng pagkabulok ng tissue ng hayop.
Ang quaternary nitrogen atom ay maaaring maging bahagi ng mga heterocycle, halimbawa, ang kaukulang asin mula sa pyridine series - N-alkylpyridinium salt. Ang nasabing mga quaternary salt ay kinabibilangan ng ilang alkaloid. Bilang karagdagan, ang quaternary nitrogen atom ay matatagpuan sa maraming mga panggamot na sangkap at ilang biomolecules.
Ang mga halimbawa sa itaas ay nagpapakita ng pagkakaiba-iba ng mga amino compound at ang kanilang mahusay na medikal at biological na kahalagahan. Kinakailangang idagdag dito na ang amino group ay bahagi ng mga klase ng biomolecules gaya ng mga amino acid at protina, nucleic acid, at naroroon sa ilang natural na carbohydrate derivatives na tinatawag na amino sugars. Ang amino group ay ang pinakamahalagang functional group ng mga alkaloid at maraming gamot para sa iba't ibang layunin. Ang ilang mga halimbawa ng mga naturang sangkap ay ibibigay sa ibaba.
24.3.2. Amines bilang mga organikong base

 Ang pagkakaroon ng isang libreng pares ng elektron ng nitrogen ay nagbibigay sa mga amin ng mga katangian ng mga base. Samakatuwid, ang isang tampok na katangian ng mga amin ay ang reaksyon sa mga acid na may pagbuo ng kaukulang mga ammonium salts, tulad ng makikita mula sa reaksyon para sa pangunahing saturated amine:
Ang pagkakaroon ng isang libreng pares ng elektron ng nitrogen ay nagbibigay sa mga amin ng mga katangian ng mga base. Samakatuwid, ang isang tampok na katangian ng mga amin ay ang reaksyon sa mga acid na may pagbuo ng kaukulang mga ammonium salts, tulad ng makikita mula sa reaksyon para sa pangunahing saturated amine:
Katulad nito, ang aniline ay nabuo mula sa aniline, ang pyridinium salt ay nabuo mula sa pyridine, atbp. Tulad ng ammonia, ang mga amin sa mga may tubig na solusyon ay lumilikha ng alkaline na kapaligiran, ayon sa equation:
Sa dami, ang basicity ng nitrogen-containing bases sa aquatic environment ay makikita ng value ng equilibrium constant. (SA b ) (mas madalas ginagamit nila ang halaga rK b ) yl/С а (ВН +), na nagpapakilala sa kaasiman ng conjugate acid ng isang ibinigay na base.

Ang pinakamalakas na base ay ang mga compound na naglalaman ng nitrogen atom kung saan ang nitrogen lone pair ay matatagpuan sa nag-iisang 5p 3 hybrid orbital (aliphatic amines, ammonia, amino acids), at ang pinakamahina ay ang mga kung saan ang pares na ito ay kasangkot sa p ,n conjugation ( amides, pyrrole, pyridine).
Ang mga substituent na nagdo-donate ng elektron, na kinabibilangan ng mga grupong alkyl, ay dapat magpataas ng basicity ng mga amine dahil pinapataas nila ang density ng elektron sa nitrogen atom. Oo, methylamine (pK b = 3.27) ay isang mas malakas na base kaysa sa ammonia (pK b = 4.75), at dimethylamine (pK b = 3.02) ay isang mas malakas na base kaysa sa methylamine. Gayunpaman, kapag lumipat sa trimethylamine, salungat sa inaasahan, ang basicity ay bumababa nang bahagya (pK b = 4.10). Ang dahilan nito ay habang ang bilang ng mga substituent sa nitrogen atom ay tumataas, ang paglapit ng proton ay lalong nagiging mahirap. Kaya, narito ang pinag-uusapan natin hindi tungkol sa electronic, ngunit ang spatial na impluwensya ng mga substituent. Ang epektong ito ng mga substituent ay tinatawag steric salik.
Ang mga aromatic na amin ay mas mahinang base kaysa sa mga saturated dahil sa epekto ng pag-withdraw ng elektron ng aromatic ring. Samakatuwid, ang basicity ng pyridine ay mababa din. Ang akumulasyon ng phenyl substituents ay kapansin-pansing pinipigilan ang aktibidad ng pares ng elektron ng nitrogen atom. Kaya, rK, ang diphenylamine ay 13.12, at ang triphenylamine ay hindi nagpapakita ng mga katangian ng isang base.
Ang napakababang basicity ng pyrrole ay sanhi ng katotohanan na sa molekula nito ang pares ng elektron ng nitrogen atom ay kasangkot sa pagbuo ng isang b-electron aromatic bond. Ang pagbubuklod nito sa isang proton ay nangangailangan ng makabuluhang karagdagang paggasta sa enerhiya. Bilang resulta ng pagbuo ng mga pyrrolium salts, ang aromatic bond, at, dahil dito, nawawala ang katatagan ng molekula. Ipinapaliwanag nito ang katotohanan na ang pyrrole ay mabilis na nagiging resinous sa isang acidic na kapaligiran.
Ito ay kagiliw-giliw na tandaan na ang malakas na electron-withdraw effect na ginawa ng pyrrole ring sa nitrogen atom ay humahantong sa isang pagpapahina ng N-H bond, dahil sa kung saan ang pyrrole ay maaaring magpakita ng mga katangian ng isang mahinang acid. (pK A = 17,5).
![]()
Sa ilalim ng impluwensya ng tulad ng isang aktibong metal bilang potasa, ang potasa asin nito, pyrrole-potassium, ay maaaring ihanda.
Ang mga acidic na katangian ng N-H bond ng pyrrole ring ay nagpapaliwanag, sa partikular, ang kakayahan ng porphin at ang mga natural na derivative nito na bumuo ng mga asing-gamot na may mga metal na kasyon. Dalawang pyrrole ring ng molekula ng porphyrin ay pinag-ugnay sa cation dahil sa mga pares ng elektron ng kanilang mga atomo ng nitrogen, at ang dalawa pa ay pinag-ugnay sa pamamagitan ng pagpapalit ng mga atomo ng hydrogen, tulad ng molekulang pyrrole mismo sa panahon ng pagbuo ng pyrrole-potassium. Ang mga asin na ito ay chlorophyll at hemoglobin.

Batay sa likas na katangian ng mga substituent ng hydrocarbon, ang mga amin ay nahahati sa
Pangkalahatang mga tampok na istruktura ng mga amine
Tulad ng sa molekula ng ammonia, sa molekula ng anumang amine ang nitrogen atom ay may nag-iisang pares ng electron na nakadirekta sa isa sa mga vertices ng distorted tetrahedron:
Para sa kadahilanang ito, ang mga amin, tulad ng ammonia, ay makabuluhang nagpahayag ng mga pangunahing katangian.
Kaya, ang mga amine, katulad ng ammonia, ay gumanti nang pabalik-balik sa tubig, na bumubuo ng mahinang mga base:
Ang bono sa pagitan ng hydrogen cation at ng nitrogen atom sa molekula ng amine ay natanto gamit ang mekanismo ng donor-acceptor dahil sa nag-iisang pares ng elektron ng nitrogen atom. Ang mga saturated amine ay mas malakas na base kumpara sa ammonia, dahil sa gayong mga amin, ang mga hydrocarbon substituent ay may positibong inductive (+I) na epekto. Sa pagsasaalang-alang na ito, ang density ng elektron sa nitrogen atom ay tumataas, na nagpapadali sa pakikipag-ugnayan nito sa H + cation.
Ang mga aromatic na amines, kung ang pangkat ng amino ay direktang konektado sa aromatic ring, nagpapakita ng mas mahinang mga pangunahing katangian kumpara sa ammonia. Ito ay dahil sa ang katunayan na ang nag-iisang pares ng elektron ng nitrogen atom ay inilipat patungo sa aromatic π-system ng benzene ring, bilang isang resulta kung saan ang density ng elektron sa nitrogen atom ay bumababa. Sa turn, ito ay humantong sa isang pagbawas sa mga pangunahing katangian, lalo na ang kakayahang makipag-ugnayan sa tubig. Halimbawa, ang aniline ay tumutugon lamang sa mga malakas na acid, ngunit halos hindi tumutugon sa tubig.
Mga kemikal na katangian ng saturated amines
Tulad ng nabanggit na, ang mga amine ay gumanti nang pabalik-balik sa tubig:
Ang mga may tubig na solusyon ng mga amin ay may alkalina na reaksyon dahil sa paghihiwalay ng mga nagresultang base:
Ang mga saturated amine ay tumutugon sa tubig na mas mahusay kaysa sa ammonia dahil sa kanilang mas malakas na mga pangunahing katangian.
Ang mga pangunahing katangian ng mga saturated amine ay tumaas sa serye.
Ang mga pangalawang saturated amine ay mas malakas na base kaysa sa pangunahing saturated amine, na kung saan ay mas malakas na base kaysa sa ammonia. Tulad ng para sa mga pangunahing katangian ng mga tertiary amine, kung pinag-uusapan natin ang tungkol sa mga reaksyon sa may tubig na mga solusyon, kung gayon ang mga pangunahing katangian ng mga tertiary amine ay ipinahayag na mas masahol pa kaysa sa mga pangalawang amin, at kahit na bahagyang mas masahol kaysa sa mga pangunahing. Ito ay dahil sa steric hindrances, na makabuluhang nakakaapekto sa rate ng amine protonation. Sa madaling salita, tatlong substituent ang "naghaharang" sa nitrogen atom at nakakasagabal sa pakikipag-ugnayan nito sa mga H + cation.
Pakikipag-ugnayan sa mga acid
Parehong ang mga libreng saturated amine at ang kanilang mga may tubig na solusyon ay tumutugon sa mga acid. Sa kasong ito, nabuo ang mga asin:
Dahil ang mga pangunahing katangian ng saturated amine ay mas malinaw kaysa sa ammonia, ang mga amin na ito ay tumutugon kahit na may mahinang mga acid, tulad ng carbonic acid:
Ang mga amine salt ay mga solido na lubos na natutunaw sa tubig at mahinang natutunaw sa mga non-polar na organikong solvent. Ang pakikipag-ugnayan ng mga amine salts na may alkalis ay humahantong sa pagpapalabas ng mga libreng amine, katulad ng pag-aalis ng ammonia kapag ang alkalis ay kumikilos sa mga ammonium salts:
2. Ang mga pangunahing saturated amine ay tumutugon sa nitrous acid upang mabuo ang kaukulang mga alkohol, nitrogen N2 at tubig. Halimbawa:
Ang isang tampok na katangian ng reaksyong ito ay ang pagbuo ng nitrogen gas, at samakatuwid ito ay husay para sa mga pangunahing amine at ginagamit upang makilala ang mga ito mula sa pangalawa at tersiyaryo. Dapat pansinin na kadalasan ang reaksyong ito ay isinasagawa sa pamamagitan ng paghahalo ng amine hindi sa isang solusyon ng nitrous acid mismo, ngunit sa isang solusyon ng asin ng nitrous acid (nitrite) at pagkatapos ay pagdaragdag ng isang malakas na mineral na acid sa pinaghalong ito. Kapag ang mga nitrite ay nakikipag-ugnayan sa malakas na mga acid ng mineral, ang nitrous acid ay nabuo, na pagkatapos ay tumutugon sa amine:
Ang mga pangalawang amin sa ilalim ng mga katulad na kondisyon ay nagbibigay ng mga madulas na likido, tinatawag na N-nitrosamines, ngunit ang reaksyong ito ay hindi nangyayari sa mga tunay na pagsubok sa PAGGAMIT sa kimika. Ang mga tertiary amine ay hindi tumutugon sa nitrous acid.
Ang kumpletong pagkasunog ng anumang mga amin ay humahantong sa pagbuo ng carbon dioxide, tubig at nitrogen:
Pakikipag-ugnayan sa mga haloalkanes
Kapansin-pansin na ang eksaktong parehong asin ay nakuha sa pamamagitan ng pagkilos ng hydrogen chloride sa isang mas pinalitan na amine. Sa aming kaso, kapag ang hydrogen chloride ay tumutugon sa dimethylamine:
Paghahanda ng mga amine:
1) Alkylation ng ammonia na may mga haloalkanes:
Sa kaso ng kakulangan sa ammonia, ang asin nito ay nakuha sa halip na amine:
2) Pagbawas ng mga metal (sa hydrogen sa serye ng aktibidad) sa isang acidic na kapaligiran:
na sinusundan ng paggamot ng solusyon na may alkali upang palabasin ang libreng amine:
3) Ang reaksyon ng ammonia sa mga alkohol kapag ipinapasa ang kanilang pinaghalong sa pamamagitan ng pinainit na aluminum oxide. Depende sa mga proporsyon ng alkohol/amin, ang pangunahin, pangalawa o tertiary na mga amin ay nabuo:
Mga kemikal na katangian ng aniline
Aniline - ang maliit na pangalan para sa aminobenzene, na may formula:
Tulad ng makikita mula sa ilustrasyon, sa aniline molecule ang amino group ay direktang konektado sa aromatic ring. Ang ganitong mga amine, tulad ng nabanggit na, ay may hindi gaanong binibigkas na mga pangunahing katangian kaysa sa ammonia. Kaya, sa partikular, ang aniline ay halos hindi tumutugon sa tubig at mga mahinang acid tulad ng carbonic acid.
Reaksyon ng aniline na may mga acid
Ang aniline ay tumutugon sa malakas at katamtamang lakas ng mga inorganikong acid. Sa kasong ito, nabuo ang mga phenylammonium salts:
Reaksyon ng aniline na may mga halogens
Gaya ng nasabi na sa pinakasimula ng kabanatang ito, ang grupo ng amino sa mga aromatic na amin ay iginuhit sa aromatic ring, na kung saan ay binabawasan ang density ng elektron sa nitrogen atom, at bilang resulta ay pinapataas ito sa aromatic ring. Ang pagtaas ng densidad ng elektron sa aromatic ring ay humahantong sa katotohanan na ang mga reaksyon ng pagpapalit ng electrophilic, sa partikular na mga reaksyon sa mga halogens, ay nagpapatuloy nang mas madali, lalo na sa mga posisyon ng ortho at para na nauugnay sa pangkat ng amino. Kaya, ang aniline ay madaling tumutugon sa bromine na tubig, na bumubuo ng isang puting precipitate ng 2,4,6-tribromoaniline:
Ang reaksyong ito ay husay para sa aniline at kadalasang pinapayagan itong makilala sa iba pang mga organikong compound.
Reaksyon ng aniline na may nitrous acid
Ang Aniline ay tumutugon sa nitrous acid, ngunit dahil sa pagiging tiyak at pagiging kumplikado ng reaksyong ito, hindi ito lumilitaw sa tunay na Pinag-isang State Exam sa kimika.
Mga reaksyon ng aniline alkylation
Gamit ang sunud-sunod na alkylation ng aniline sa nitrogen atom na may halogenated hydrocarbons, ang pangalawang at tertiary na mga amin ay maaaring makuha:
Mga kemikal na katangian ng mga amino acid
Mga amino acid ay mga compound na ang mga molekula ay naglalaman ng dalawang uri ng functional group - amino (-NH 2) at carboxy- (-COOH) na mga grupo.
Sa madaling salita, ang mga amino acid ay maaaring ituring bilang mga derivatives ng mga carboxylic acid, sa mga molekula kung saan ang isa o higit pang mga hydrogen atom ay pinalitan ng mga amino group.
Kaya, ang pangkalahatang pormula ng mga amino acid ay maaaring isulat bilang (NH 2) x R(COOH) y, kung saan ang x at y ay kadalasang katumbas ng isa o dalawa.
Dahil ang mga molekula ng amino acid ay naglalaman ng parehong isang amino group at isang carboxyl group, sila ay nagpapakita ng mga kemikal na katangian na katulad ng parehong mga amine at carboxylic acid.
Mga acidic na katangian ng mga amino acid
Pagbubuo ng mga asing-gamot na may alkalis at alkali metal carbonates
Esterification ng mga amino acid
Ang mga amino acid ay maaaring tumugon sa esterification sa mga alkohol:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Mga pangunahing katangian ng mga amino acid
1. Pagbubuo ng mga asin kapag nakikipag-ugnayan sa mga acid
NH 2 CH 2 COOH + HCl → + Cl —
2. Pakikipag-ugnayan sa nitrous acid
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Tandaan: ang pakikipag-ugnayan sa nitrous acid ay nagpapatuloy sa parehong paraan tulad ng sa mga pangunahing amin
3. Alkylation
NH 2 CH 2 COOH + CH 3 I → + I —
4. Interaksyon ng mga amino acid sa isa't isa
Ang mga amino acid ay maaaring mag-react sa isa't isa upang bumuo ng mga peptides - mga compound na naglalaman sa kanilang mga molekula ng peptide bond –C(O)-NH-
Kasabay nito, dapat tandaan na sa kaso ng isang reaksyon sa pagitan ng dalawang magkakaibang amino acid, nang hindi sinusunod ang ilang mga tiyak na kondisyon ng synthesis, ang pagbuo ng iba't ibang mga dipeptides ay nangyayari nang sabay-sabay. Kaya, halimbawa, sa halip na ang reaksyon ng glycine na may alanine sa itaas, na humahantong sa glycylananine, ang reaksyon na humahantong sa alanylglycine ay maaaring mangyari:
Bilang karagdagan, ang molekula ng glycine ay hindi kinakailangang tumugon sa molekula ng alanine. Nagaganap din ang mga reaksyon ng peptization sa pagitan ng mga molekula ng glycine:
At alanine:
Bilang karagdagan, dahil ang mga molekula ng mga nagresultang peptide, tulad ng orihinal na mga molekula ng amino acid, ay naglalaman ng mga grupo ng amino at mga grupo ng carboxyl, ang mga peptide mismo ay maaaring tumugon sa mga amino acid at iba pang mga peptide dahil sa pagbuo ng mga bagong peptide bond.
Ang mga indibidwal na amino acid ay ginagamit upang makagawa ng mga sintetikong polypeptides o tinatawag na polyamide fibers. Kaya, sa partikular, gamit ang polycondensation ng 6-aminohexane (ε-aminocaproic) acid, ang nylon ay synthesize sa industriya:
Ang resultang naylon resin ay ginagamit upang makagawa ng mga hibla ng tela at plastik.
Ang pagbuo ng mga panloob na asing-gamot ng mga amino acid sa may tubig na solusyon
Sa mga may tubig na solusyon, ang mga amino acid ay nakararami sa anyo ng mga panloob na asin - bipolar ions (zwitterions).
Ang anumang amine ay may nag-iisang pares ng mga electron sa nitrogen atom nito. Kapag ang isang amine ay pumasok sa tubig, ang mga proton mula sa tubig ay maaaring, sa pamamagitan ng isang donor-acceptor na mekanismo, ay bumuo ng isang bagong covalent polar bond na may nitrogen atom, sa gayon ay gumagawa ng isang alkyl o aryl ammonium ion. Ang tubig na nawalan ng proton ay nagiging hydroxide ion. Nagiging alkaline ang kapaligiran. Kaya ang mga amin ay mga base. Ang lakas ng mga base na ito ay nakasalalay sa kalikasan at bilang ng mga radikal na nauugnay sa nitrogen. Ang mga aliphatic radical, tulad ng methyl, ethyl, atbp., na nagpapakita ng kanilang mga katangian ng pag-donate ng elektron, ay nagpapataas ng basicity ng mga amine. Ang mga aromatic radical, sa kabaligtaran, dahil sa delokalisasi ng isang pares ng mga electron sa singsing ng benzene, ay lubos na binabawasan ang basicity. Sa mga tuntunin ng teorya ng resonance ni Linus Pauling, ganito ang hitsura:
Tulad ng nakikita mo, ang isang nag-iisang pares ng mga electron ay naroroon sa nitrogen atom lamang sa isa sa mga istruktura ng resonance (mesomeric form). Sa iba pang tatlong bipolar na istruktura, sa kabaligtaran, mayroong isang "+" sa nitrogen atom - isang singil na natural na pumipigil sa protonation. Ito ang dahilan ng matinding pagbaba sa basicity. Availability sa O- At P- Ang mga posisyon ng mga negatibong singil ay nagpapahintulot sa amin na gumawa ng isang pagpapalagay tungkol sa kadalian ng mga reaksyon ng pagpapalit ng electrophilic na nagaganap nang eksakto sa mga posisyon na ito, kung saan ang umaatakeng particle ay isang cation (halimbawa,
![]() ) Nasa ibaba ang mga halimbawa ng mga reaksyon ng ganitong uri sa mga aromatic amine.
) Nasa ibaba ang mga halimbawa ng mga reaksyon ng ganitong uri sa mga aromatic amine.
Sa dami, ang lakas ng mga base ay nailalarawan sa pamamagitan ng mga halaga ng K b o ang kanilang mga negatibong logarithms pK b . Ang index na "b" ay nangangahulugan na pinag-uusapan natin ang equilibrium constant sa pagitan ng base, na isang amine, at ang conjugate acid nito, iyon ay, ang ammonium ion:
Sa pamamagitan ng kahulugan, ang gayong nababaligtad na reaksyon ay inilarawan ng analytical expression:

Dahil ang konsentrasyon ng tubig sa dilute aqueous solution ay halos pare-pareho at katumbas ng 55.5 mol/l, pagkatapos ay kasama ito sa "bagong" equilibrium constant:

Ang pagpaparami ng numerator at denominator ng kanang bahagi ng equation sa pamamagitan ng [H + ] at isinasaalang-alang na ang [H + ] [OH - ] = K w = 10 -14 ay nakukuha natin:

Pag-logarithmizing ng analytical expression na ito gamit ang decimal logarithms,
dumating tayo sa equation:

Ang pagpapalit ng mga palatandaan sa kabaligtaran at pagpapakilala ng pangkalahatang tinatanggap na notasyon: - lg = p, nakukuha natin:

Dahil ang logarithm ng pagkakaisa sa anumang base ay katumbas ng zero, at ang 14 ay pH = pOH, malinaw na ang pK b ay tumutugma sa halaga ng konsentrasyon ng mga hydroxyl ions kung saan ang kalahati ng mga ammonium cations ay pupunta sa pag-alis ng isang proton sa isang libreng amine. Ang halaga ng pK b para sa mga base ay may parehong kahulugan sa halaga ng pK a para sa mga acid. Nasa ibaba ang isang talahanayan kung saan ang data ay nagpapakita ng impluwensya ng likas na katangian ng mga radical at ang kanilang dami sa mga halaga ng mga pangunahing constant ng iba't ibang mga amine.
| Base pangalan | Base formula | Uri ng base | K b sa 25 o C | pK b na halaga sa 25 o C |
| Ammonia | 1,75 10 -5 | 4,75 | ||
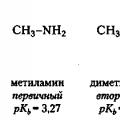
| Methylamine | Pangunahin aliphate | 4,60 10 - 4 | 3,34 | |
| Ethylamine | | Pangunahin aliphate | 6,50 10 - 4 | 3,19 |
| Butylamine | Pangunahin aliphate | 4,00 10 - 4 | 3,40 | |
| Isobutiamine | | Pangunahin aliphate | 2,70 10 - 4 | 3,57 |
| Deut.-butylamine | | Pangunahin aliphate | 3,60 10 - 4 | 3,44 |
| Tret-butylamine | Pangunahin aliphate | 2,80 10 - 4 | 3,55 | |
| Benzylamine | | Pangunahin aliphate | 2,10 10 -5 | 4,67 |
| Dimethylamine | Pangalawa aliphate | 5,40 10 -4 | 3,27 | |
| Diethylamine | Pangalawa aliphate | 1,20 10 - 3 | 2,91 | |
| Trimethylamine | Tertiary aliphate | 6,50 10 -5 | 4,19 | |
| Triethylamine | | Tertiary aliphate | 1,00 10 - 3 | 3,00 |
| Aniline | Pangunahin bango. | 4,30 10 - 10 | 9,37 | |
| P-toluidine | | Pangunahin bango. | 1,32 10 -9 | 8,88 |
| P-nitroaniline | | Pangunahin bango. | 1,00 10 - 13 | 13,0 |
| N,N-dimethylaniline | Tertiary mataba na mabango | 1,40 10 -9 | 8,85 | |
| Diphenylamine | Pangalawa bango. | 6,20 10 -14 | 13,21 | |
| Pyridine | Heteroaromatic | 1,50 10 - 9 | 8,82 | |
| Quinoline | Heteroaromatic | 8,70 10 -10 | 9,06 | |
| Piperidine | Pangalawa aliphate at heterocyclic | 1,33 10 -3 | 3,88 | |
| Hydrazine | 9,30 10 -7 | 6,03 | ||
| Hydroxylamine | 8,90 10 - 9 | 8,05 | ||
| Ethanolamine | Prod. una alif. | 1,80 10 - 5 | 4,75 |
Ang mga talahanayan na ito ay nagpapahintulot sa amin na gumuhit ng mga sumusunod na konklusyon:
1) Ang mga aliphatic amine ay mas malakas na base kaysa sa mga aromatic amine (mga 100,000 - 1,000,000 beses)
2) Ang heteroaromatic amines ay malapit sa basicity sa mga aromatic.
3) Ang basicity ng aromatic amines ay malakas na naiimpluwensyahan ng mga substituent na matatagpuan sa pares- posisyon sa amino group. Ang mga pamalit na nagdo-donate ng elektron ay nagpapataas ng basicity ng amine, habang ang mga substituent na nag-withdraw ng elektron ay binawasan ito nang husto. Ang basicity ratio ng mga aromatic amines na naglalaman ng mga methyl at nitro group sa ipinahiwatig na posisyon ay humigit-kumulang 10,000: 1.
4) Ang mga pangalawang aliphatic amin ay bahagyang mas basic kaysa sa mga pangunahing amin, habang ang mga tertiary aliphatic amin ay may basicity sa parehong antas.
5) Ang likas na katangian ng radical sa mga pangunahing amin ay hindi gaanong nakakaapekto sa basicity ng amine.
6) Ang mga saturated heterocyclic amine ay may basicity sa antas ng pangalawang aliphatic amines.
7) Ang matabang aromatic amines ay may basicity sa antas ng aromatic amines.
8) Ang mga pangalawang aromatic amine ay may basicity na humigit-kumulang 10,000 beses na mas mababa kaysa sa mga pangunahing.
9) Ang mga electronegative atoms na nakagapos sa isang molekula sa nitrogen atom ng amino group ay binabawasan ang basicity nito ng 10 (nitrogen) at 1000 beses (oxygen).
10) Ang isang oxygen atom na pinaghihiwalay mula sa amino group ng dalawang methylene group ay binabawasan ang basicity nito ng 67 beses lamang.
Dapat ding tandaan na ang basicity ng acid amides dahil sa electron-withdraw effect ng carbonyl group ay napakababa - kahit na mas mababa kaysa sa pangalawang aromatic amines: para sa acetamide pK b = 13.52; para sa acetanilide pK b = 13.60 at para sa urea pK b = 13.82
acetamide acetanilide urea
Parang grounds pangunahin, pangalawa at tersiyaryong mga amin gumanti may mga acid:
propylamine propylammonium bromide
dimethylamine dimethylammonium sulfate
trimethylamine trimethylammonium perchlorate
Sa polybasic acids hindi lamang mga average ang maaaring mabuo, ngunit at mga acid salt:
dimethylamine dimethylammonium hydrogen sulfate
methylisobutylamine methylisobutylammonium dihydrogen orthophosphate
Pangunahing aromatics, at pangalawa at tertiary fatty aromatic amines na may dilute aqueous solutions ng strong acids ay nagbibigay din asin:


May kakayahan din silang bumuo asin Sa ilalim ng impluwensiya puro malakas na acids, ngunit sa diluted na may tubig ang mga asin na ito hydrolyze, nagbibigay ng mahinang batayan, kumbaga magulang amine:

Tulad ng napakahina na pundasyon, huwag magbigay ng asin ni sa puro hydrochloric o sulfuric acids. Totoo, ang triphenylamine ay gumagawa pa rin ng perchlorate na may perchloric acid:

.
Pangunahing aliphatic amines gumanti sa dalawang yugto: sa una, labis hindi matatag sa tubig kahit na pinalamig diazonium na asin, na sa ikalawang yugto ay tumutugon sa tubig upang mabuo alak:
propylamine propyldiazonium chloride
propanol-1
Sa reaksyon ng isang pangunahing amine na may sodium nitrite at hydrochloric acid, outgassing(malinaw na nakikita ang mga bula) at malansang amoy pagbabago ng amine sa alak ay isang qualitative na reaksyon sa isang pangunahing aliphatic amine.
Kung susumahin natin ang dalawang reaksyon sa itaas, makukuha natin:
Mga pangalawang amin ganap na naiiba ang reaksyon: sa ilalim ng impluwensya ng sodium nitrite at hydrochloric acid, N-nitrosamine- napaka-stable na koneksyon kahit na pinainit:
methylethylamine N-nitrosomethylethiamine
Sa reaksyon ng pangalawang aliphatic amine na may sodium nitrite at hydrochloric acid, pagbuo ng isang dilaw na langis, hindi gaanong natutunaw sa tubig at may labis na hindi kanais-nais na amoy ay isang qualitative na reaksyon sa isang pangalawang aliphatic amine.
Nitrosamines - carcinogens: anuman ang lugar at paraan ng pagpasok sa katawan ng isang eksperimentong hayop, nagiging sanhi sila ng kanser sa atay. Malawakang ginagamit sa pang-eksperimentong oncology. Kumikilos sila nang resorptive, iyon ay, sa pamamagitan ng balat.
Tertiary aliphatic amines reaksyon mula sa pinaghalong sodium nitrite at hydrochloric acid may acid lang:
Walang nakikitang epekto sa reaksyong ito. Humina ang amoy.
Pangunahing aromatic amines gumanti upang bumuo ng medyo matatag sa mga temperatura mula 0 hanggang 5 o C diazonium salts. Ang reaksyong ito ay unang inilathala noong 1858 sa isang German chemical journal ni Peter Griess at dinadala ang kanyang pangalan:
Ang reaksyon ng Griess ay nagsasangkot ng maraming mga homolog ng aniline na naglalaman ng mga alkyl substituents sa o-,m- At P-posisyon sa amino group:
Kasama rin dito ang mga aniline derivatives na naglalaman ng electron-withdraw, electron-donate substituents at substituents ng isang espesyal na grupo, halimbawa:
Sa hydrobromic acid ang reaksyon ay mas mabilis, ngunit ito ay bihirang ginagamit at lamang sa laboratoryo dahil sa mataas na gastos at kakulangan ng acid na ito.
Sa paggawa ng mga diazonium salts, agad silang ginagamit para sa mga sumusunod na yugto ng synthesis, ngunit sa laboratoryo sila ay madalas na nakahiwalay sa pamamagitan ng isang reaksyon ng palitan na may isang puspos na solusyon ng sodium tetrafluoroborate:

Ang diazonium salts ay kadalasang ginagamit upang makakuha ng maraming azo dyes sa pamamagitan ng azo coupling na may phenols (naphthols) at aromatic tertiary amines, halimbawa:


Ang nagreresultang azo dye ay isang pH indicator: sa isang acidic na kapaligiran, dahil sa pagbuo ng isang hydrogen bond, mayroon itong isang patag na istraktura kung saan ang electron-donate effect ng hydroxyl group ay humina - ang form na ito ay may kulay na dilaw. Sa alkaline na grupo, ang isang proton ay inalis mula sa hydroxyl group, isang "phenolate ion" ang lilitaw, na siyang pinakamalakas na ED substituent, at ang kulay ay nagbabago sa pula-orange:

Ang papel ng soda sa reaksyon ng azo coupling ay ang pagbubuklod ng nagresultang hydrochloric (o iba pang malakas) acid sa isang acid salt - sodium bikarbonate:
Ang pinaghalong sodium carbonate at sodium bicarbonate ay isang buffer solution na lumilikha ng bahagyang alkaline na kapaligiran.
Sa tertiary aromatic amines, ang azo coupling ay dapat maganap sa isang bahagyang acidic na kapaligiran, na sinisiguro ng pagdaragdag ng mga salts na nag-hydrolyze sa anion, halimbawa, sodium acetate. Sa isang malakas na acidic na kapaligiran, ang amine ay gumagawa ng isang ammonium salt, ang cation nito ay hindi natural na tumutugon sa diazonium cation.


Ang sodium acetate ay agad na tumutugon sa nagreresultang hydrochloric acid. Ang resulta ay isang buffer solution na binubuo ng mahinang acetic acid at labis na sodium acetate. Nagbibigay ito ng bahagyang acidic na kapaligiran:
Pangalawang aromatic amines gumanti na may sodium nitrite at hydrochloric acid may edukasyon N-nitrosamines. Halimbawa, ang N-methylaniline ay nagbibigay ng N-nitroso-N-methylaniline, isang dilaw na langis na may labis na hindi kanais-nais na amoy, na tumitigas sa 13 °C:
Ang mga mabangong N-nitrosoamines, tulad ng mga aliphatic, ay mga carcinogens. Nagdudulot din sila ng kanser sa atay at ginagamit din sa eksperimentong oncology.
Ang mabangong N-nitrosoamines sa ilalim ng impluwensya ng dry hydrogen chloro- o bromide o sa ilalim ng impluwensya ng concentrated sulfuric acid ay sumasailalim sa muling pagsasaayos, na unang inilathala noong 1886 sa isang German chemical journal nina O. Fischer at E. Hepp. Sa ilalim ng mga kundisyong ito, ang pangkat ng nitroso ay piling inililipat sa P-posisyon:
Ang 4-nitroso-N-methylaniline na nakuha bilang resulta ng muling pagsasaayos ay may ganap na magkakaibang pisikal na katangian at biological na aktibidad. Ito ay isang berdeng solid na may temperatura ng pagkatunaw na 113 °C. Nag-fluores ito sa mga solusyon sa mga organikong solvent. Ito ay hindi isang carcinogen, bagaman ito ay nagiging sanhi ng dermatitis.
Tertiary aromatic amines gumanti na may sodium nitrite at hydrochloric acid, Pagbibigay Mga compound ng C-nitroso. Ang pangkat ng nitroso ay piling nakadirekta sa P-posisyon:
Ang mga C-nitroso compound ay madaling nababawasan ng hydrogen sa Raney nickel. Gumagawa ito ng mga hindi simetriko na dialkyldamine, halimbawa:
Ang mga asin ng aliphatic at aromatic amines ay madaling ma-convert pabalik sa amines sa pamamagitan ng pagkilos ng alkalis, halimbawa:
propylammonium perchlorate propylamine
methylpropylammonium hydrogen sulfate methylpropylamine

Quaternary ammonium base, sa kabaligtaran, maaaring isalin sa quaternary ammonium salts aksyon mga acid:
Dimethylethylisopropylammonium hydroxide dimethylethylisopropylammonium chloride
Tulad ng nakikita mo, ito ay isang pangkaraniwang reaksyon ng pag-neutralize ng alkali na may acid - nakuha ang asin at tubig.
Sa pahina 19 ng manwal na ito, iminungkahi na ang electrophilic substitution reactions ay madaling mangyari sa mga aromatic na amine sa ortho- At pares-posisyon ng singsing ng benzene. Sa katunayan, ang aniline ay madaling na-brominated sa lahat ng mga posisyong ito nang sabay-sabay:

N,N-dialkylanilines ay sulfonated, nitrated, at diazotized sa ortho- At pares-mga posisyon:




Ang sodium acetate ay nagpapalit ng isang malakas na kumplikadong acid sa isang mahinang acid: acetic acid:
Paglalapat ng mga amine
Ang pinakasimpleng pangunahing amine ay methylamine ginagamit sa synthesis ng insecticides, fungicides, vulcanization accelerators, surfactant, gamot, dyes, rocket fuels, at solvents. Halimbawa, ang N-methyl-2-pyrrolidone, isang sikat na solvent para sa mga barnis at ilang mga tina, ay nakukuha sa pamamagitan ng pagtugon sa methylamine sa γ-butyrolactone (cyclic ester ng 4-hydroxybutanoic acid):

γ-butyrolate N-methyl-2-pyrrolidone
Ang pinakasimpleng pangalawang amine ay dimethylamine ginagamit sa synthesis ng insecticides, herbicides, vulcanization accelerators, surfactant, maraming gamot, dyes at mga mahalagang solvents gaya ng dimethylforiamide (DMF), dimethylacetamide (DMAA) at hexamethylphosphorotriamide (HMPTA) o hexamethapol. Ang DMF ay ginawa sa industriya, halimbawa, sa pamamagitan ng pagtugon sa dimethylamine sa formic acid methyl ester:
methyl formate dimethylamine DMF methanol
Ang DMAA ay ginawa sa industriya sa pamamagitan ng pagtugon sa dimethylamine na may acetic anhydride:
acetic anhydride DMAA
Ang pang-industriyang synthesis ng hexamethapol ay nagsasangkot ng pakikipag-ugnayan ng dimethylamine sa phosphorus oxychloride:

posporus trichloride HMPTA
Ang pinakasimpleng tertiary amine ay trimethylamine ginagamit sa synthesis ng quaternary ammonium base, flotation agent, retardants, feed additives. Halimbawa, ang huling yugto ng synthesis ng carbacholine, isang gamot na ginagamit sa paggamot ng glaucoma at postoperative na bituka o pantog ng pantog, ay nagsasangkot ng pakikipag-ugnayan ng trimethylamine sa carbamoyl derivative ng ethylene chlorohydrin:
carbacholine
Ang mga cationic surfactant ay nakuha sa katulad na paraan:
trimethylalkylammonium chloride
Ethylamine ginagamit sa paggawa ng mga tina, surfactant, herbicide. Halimbawa, ang simazine, isang herbicide para sa pagprotekta sa mais at gulay mula sa mga damo, ay nakuha sa pamamagitan ng pagtugon sa ethylamine na may kinakalkula na halaga ng cyanuric chloride sa isang alkaline na medium:
chlorocyanur simazine
Diethylamine ginagamit sa paggawa ng mga tina, pestisidyo, rubber vulcanization accelerators, corrosion inhibitors, gamot, at repellents. Halimbawa, ang kilalang mosquito repellent DEET ay nakuha sa pamamagitan ng reaksyon:

acid chloride m-toluic acid N,N-diethyl- m-toluamide
Isopropylamine, butylamine, isobutylamine, martes-butiamine at tert- butylamines ginagamit sa mga katulad na industriya.
1,6-hexanediamine malawakang ginagamit para sa synthesis ng nylon sa pamamagitan ng polycondensation reaction na may 1,4-butanedicarboxylic (adipic) acid:

Sa mga gamot, marami ang naglalaman ng mga amino group ng iba't ibang uri. Kaya, halimbawa, sa 1308 na gamot na nakalista sa sangguniang aklat ng M.D. Mashkovsky, hindi bababa sa 70 ay pangunahing mga amin, hindi bababa sa 52 ay pangalawa at hindi bababa sa 108 ay tersiyaryo. Bilang karagdagan, kabilang sa mga gamot ay mayroong 41 quaternary ammonium salts at higit sa 70 amides ng carboxylic acids, 26 amides ng arylsulfonic acids at 12 amides ng orthophosphoric acid derivatives. Mayroon ding mga cyclic amides - lactams. Mayroong 5 mga pangalan. Mga derivatives ng natural na amino acids – 14 na pangalan. Nasa ibaba ang mga halimbawa ng mga gamot na naglalaman ng mga nakalistang functional na grupo:
Anestezin- ethyl eter P-aminobenzoic acid. Ito ay isang pangunahing aromatic amine at isang ester sa parehong oras.

May local anesthetic effect. Ito ay ginagamit upang mapawi ang sakit sa mga sugat at ulser, para sa pagsusuka sa panahon ng pagbubuntis, at para sa mga sakit sa dagat at hangin.
Baclofen– 4-amino-3-( P-chloro)phenylbutanoic acid. Ito ay isang pangunahing aliphatic amine, isang ester at isang halogen derivative ng serye ng benzene sa parehong oras.

Binabawasan ang pag-igting ng kalamnan at may analgesic effect. Ginagamit para sa multiple sclerosis.
Salbutamol – 2-kuskusin-butylamino-1-(4"-hydroxy-3"-hydroxymethyl)phenylethanol. Ito ay isang pangalawang aliphatic amine, pangalawa at pangunahing mga alkohol at phenol sa parehong oras.

Ito ay may bronchodilator effect at pinipigilan ang napaaga na contraction sa mga buntis na kababaihan. Ito ay ginagamit para sa bronchial hika at sa obstetric practice.
Ortofen– sodium salt ng 2-(2",6"-dichloro)phenylaminophenylacetic acid. Ito ay isang pangalawang aromatic amine, isang asin ng isang carboxylic acid at isang halogen derivative ng serye ng benzene sa parehong oras.

Mayroon itong anti-inflammatory, analgesic at antipyretic effect. Ito ay ginagamit para sa talamak na rayuma, rheumatoid arthritis, ankylosing spondylitis, arthrosis, spondyloarthrosis.
Isoverine– N-isoamyl-1,5-pentanediamine dihydrochloride. Ito ay isang diammonium na asin ng pangunahin at pangalawang amin sa parehong oras.

Pinapababa ang presyon ng dugo, pinatataas ang tono at pinahuhusay ang mga contraction ng mga kalamnan ng matris. Ito ay ginagamit bilang isang labor accelerator at upang pasiglahin ang pag-urong ng matris sa panahon ng postpartum.
Methylene blue– N,N,N’,N’-tetramethylthionine chloride. Ito ay parehong isang tertiary fatty aromatic amine at isang ammonium salt ng parehong amine. Bilang karagdagan, naglalaman ito ng heteroaromatic ring na may "pyridine" nitrogen atom.

Ginagamit sa labas bilang isang antiseptiko para sa mga paso, pyoderma at folliculitis. Para sa cystitis at urethritis, ang mga cavity ay hugasan ng isang 0.02% na asul na solusyon.
Pentamin– 3-methyl-1,5-bis-(N,N-dimethyl-N-ethyl)ammonium-3-azapentane dibromide. Ito ay parehong isang tertiary aliphatic amine at isang dobleng quaternary ammonium salt ng parehong mga amine.

May ganglion-blocking activity. Ginagamit para sa hypertensive crises, spasms ng peripheral vessels, spasms ng bituka at biliary tract, renal colic, upang mapawi ang talamak na pag-atake ng bronchial hika, at para sa pulmonary at cerebral edema.
Nicotinamide– 3-pyridinecarboxylic acid amide. Ito ay isang carboxylic acid amide at isang derivative ng nitrogen-containing heteroaromatic ring - pyridine.

Mayroon itong mga anti-pellagric na katangian, nagpapabuti ng metabolismo ng carbohydrate, at may positibong epekto sa mga banayad na uri ng diabetes, mga sakit sa atay at puso, at mga ulser sa tiyan at duodenal. Ginagamit para sa gastritis na may mababang kaasiman, talamak at talamak na hepatitis, cirrhosis, para sa mga spasms ng mga daluyan ng dugo sa mga limbs, bato at utak.
Sulfadimezin – 2-(P- aminobenzenesulfamido)-4,6-dimethylpyrimidine. Kinatawan ng isang malaking grupo ng mga gamot na sulfonamide. Ito ay parehong sulfanilamide, isang pangunahing aromatic amine at isang derivative ng nitrogen-containing heteroaromatic ring - pyrimidine.

Tulad ng lahat ng mga gamot sa grupong ito, ang sulfadimezin ay isang aktibong antimicrobial agent. Ginagamit ito para sa pneumococcal, streptococcal, meningococcal infections, sepsis, gonorrhea, pati na rin sa mga impeksyong dulot ng E. coli at iba pang microbes.
Fopurine – 6-diethylenamidophosphamido-2-dimethylamino-7-methylpurine. Ito ay sabay-sabay na isang triple phosphamide, isang tertiary aromatic amine at isang derivative ng isang nitrogen-containing heteroaromatic na bisikleta - purine
Hemodez– 6% water-salt solution ng mababang molekular na timbang na polyvinylpyrrolidone. Ang elementary unit ng polimer ay naglalaman ng lactam ring.

Nagbubuklod sa mga toxin na nagpapalipat-lipat sa dugo at mabilis na inaalis ang mga ito sa pamamagitan ng renal barrier. Ginagamit para sa dysentery, dyspepsia, salmonellosis, at sakit sa paso sa yugto ng pagkalasing.
Histidine– L-β-imidazolylalanine o L-α-amino-β-(4-imidazolyl)propionic acid. Ito ay isang α-amino acid at isang derivative ng nitrogen-containing heteroaromatic ring - imidazole

Ang histidine ay isang mahalagang amino acid; Natagpuan sa iba't ibang mga organo, ito ay bahagi ng carnosine, isang nitrogenous extractive substance sa mga kalamnan. Sa katawan ito ay sumasailalim sa decarboxylation na may pagbuo ng histamine, isa sa mga kemikal na kadahilanan (mediators) na kasangkot sa regulasyon ng mahahalagang function.
Angiotensinamide– L-asparaginyl-L-arginyl-L-valyl-L-tyrosinyl-L-valyl-L-histidinyl acetate – L-prolyl-L-phenylalanine. Ito ay isang acetic acid na asin ng isang octapeptide na binubuo ng mga natural na α-amino acid.

Sa mga kondisyon ng pagkabigla, ginagamit ito para sa mabilis at malakas na pagsisikip ng mga daluyan ng dugo sa mga panloob na organo, balat, at bato. Ang Angiotensinamide ay mayroon ding kakayahan na kontrahin ang makinis na kalamnan ng matris, bituka, pantog at apdo. Pinasisigla nito ang pagpapalabas ng adrenaline mula sa mga glandula ng adrenal at ang paggawa ng aldosteron.
| Amines. Kahulugan | |
| Pag-uuri ng mga amin ayon sa bilang ng mga atomo ng hydrogen sa ammonia na pinalitan ng mga radikal | |
| Pag-uuri ng mga amin ayon sa likas na katangian ng mga radikal na nauugnay sa nitrogen atom | |
| Isomerism at nomenclature ng aliphatic amines | |
| Mga pamamaraan para sa paggawa ng mga amine | |
| Paghahanda ng mga amin mula sa iba pang mga compound na naglalaman ng nitrogen | |
| Mula sa mga compound ng nitro | |
| Mula sa mga compound ng nitroso | |
| Mula sa mga oxime | |
| Mula sa hydrazones | |
| Mula sa mga amide ng carboxylic acid | |
| Mula sa carboxylic acid nitriles: 7 | |
| Paghahanda ng mga amin mula sa mga compound ng iba pang mga klase | |
| Mula sa aldehydes at ketones sa pamamagitan ng reaksyon ng Leuckart-Wallach | |
| Paghahanda ng pangunahing aliphatic amines sa pamamagitan ng ammonia alkylation | |
| Paghahanda ng pangalawang aliphatic amin sa pamamagitan ng alkylation ng mga pangunahing | |
| Paghahanda ng tertiary aliphatic amines sa pamamagitan ng alkylation ng mga pangalawang | |
| Paghahanda ng quaternary ammonium salts mula sa tertiary amines | |
| Paghahanda ng quaternary ammonium base mula sa quaternary ammonium salts | |
| Thermolysis ng quaternary ammonium base | |
| Alkylation ng pangunahing aromatic amines sa simetriko | |
| tertiary amines | |
| Apat na hakbang na synthesis ng pangalawang mataba na aromatic amines | |
| Paghahanda ng mga purong pangunahing amin ayon kay Gabriel | |
| Paghahanda ng mga amin mula sa mga alkohol | |
| Paghahanda ng aromatic amines | |
| Pagbawas ng mga aromatic nitro compound ayon sa N.N. Zinina | |
| Pagbawas ng mga aromatic nitro compound ayon kay Bechamp | |
| Catalytic reduction ng aromatic nitro compounds na may hydrogen | |
| Mga pisikal na katangian ng aliphatic amines | |
| Pisikal na estado ng aliphatic amines | |
| Pag-asa ng mga punto ng kumukulo ng aliphatic amines sa istraktura | |
| Ang solubility ng aliphatic amines sa tubig at mga organikong solvent | |
| Mga pisikal na katangian ng aromatic amines | |
| Pisikal na estado at solubility ng aromatic amines | |
| Mga kemikal na katangian ng mga amine | |
| Relasyon sa pagitan ng elektronikong istraktura ng mga amin at basicity | |
| Basicity constants at pK b values para sa aliphatic, aromatic at heterocyclic amines at ilang kaugnay na compound | |
| Mga reaksyon ng mga amin na may mga acid | |
| Pakikipag-ugnayan ng mga amin na may sodium nitrite at hydrochloric acid | |
| Conversion ng pangunahing aliphatic amines sa mga alkohol sa pamamagitan ng diazo compounds | |
| Conversion ng pangalawang aliphatic amines sa N-nitroso compounds | |
| Carcinogenicity ng aliphatic N-nitrosamines | |
| Pakikipag-ugnayan ng tertiary aliphatic amines na may sodium nitrite | |
| at hydrochloric acid | |
| Conversion ng pangunahing aromatic amines sa diazonium salts | |
| Paghihiwalay ng mga diazonium salts mula sa mga solusyon sa anyo ng mga tetrafluoroborates | |
| Azose coupling reaction na may phenols (naphthols) | |
| Ang Azo dyes bilang pH indicator | |
| Azo coupling reaction na may tertiary aromatic amines | |
| Conversion ng pangalawang mataba aromatic amines sa N-nitrosamines | |
| Carcinogenicity ng fatty-aromatic N-nitrosamines | |
| Pag-aayos ng Fischer-Hepp | |
| Conversion ng tertiary aromatic amines sa C-nitroso compounds | |
| Catalytic reduction ng aromatic C-nitroso compounds na may hydrogen | |
| Pakikipag-ugnayan ng mga asing-gamot ng aliphatic at aromatic amines na may alkalis | |
| Pakikipag-ugnayan ng mga quaternary ammonium base sa mga acid | |
| Mga reaksyon ng pagpapalit ng electrophilic sa mga aromatic amines | |
| Paglalapat ng mga amine | |
| Paglalapat ng methyl at dimethylamine | |
| Paghahanda ng mga sikat na organic solvents: DMF, DMAA at HMPTA | |
| Paglalapat ng trimethyl at ethylamines | |
| Paglalapat ng diethylamine | |
| Application ng diamines para sa produksyon ng polyamide polymers | |
| Mga gamot – amine at amine derivatives | |
| Anestezin | |
| Baclofen | |
| Salbutamol | |
| Ortofen | |
| Isoverine | |
| Methylene blue | |
| Pentamin | |
| Nicotinamide | |
| Sulfadimezin | |
| Fopurine | |
| Hemodez | |
| Histidine | |
| Angiotensinamide | |
| Nilalaman |
Ang mga amin ay ang tanging klase ng mga organikong compound na kapansin-pansing basic. Gayunpaman, ang mga amin ay mahinang base. Ngayon ay magiging kapaki-pakinabang na bumalik sa talahanayan. 12-1 upang alalahanin ang tatlong kahulugan ng mga acid at base. Ayon sa tatlong kahulugan ng basicity, tatlong aspeto ng kemikal na pag-uugali ng mga amin ay maaaring makilala.
1. Ang mga amine ay tumutugon sa mga acid, na kumikilos bilang mga proton acceptors:
Samakatuwid, ang mga amin ay mga base ng Bronsted. 2. Ang mga amin ay mga donor ng pares ng elektron (mga base ng Lewis):

3. Ang mga may tubig na solusyon ng mga amin samakatuwid, ang mga amin, kapag nakikipag-ugnayan sa tubig, ay may kakayahang bumuo ng mga hydroxide anion

Samakatuwid, ang mga amin ay mga base ng Arrhenius. Bagama't ang lahat ng mga amin ay mahinang base, ang kanilang basicity ay nakasalalay sa kalikasan at bilang ng mga hydrocarbon radical na nakakabit sa nitrogen atom. Ang mga alkylamine ay mas basic kaysa sa mga aromatic na amine. Kabilang sa mga alkylamine, ang pinaka-basic ay ang mga pangalawang, ang mga pangunahin ay medyo hindi gaanong basic, na sinusundan ng mga tertiary amine at ammonia. Sa pangkalahatan, bumababa ang basicity sa pagkakasunud-sunod:
Ang isang sukatan ng basicity ng isang substance ay ang basicity constant, na siyang equilibrium constant ng interaksyon ng isang amine sa tubig (tingnan ang Arrhenius definition ng basicity sa itaas). Dahil ang tubig ay naroroon sa labis na labis, ang konsentrasyon nito ay hindi lilitaw sa pagpapahayag ng pare-parehong basicity:

Kung mas malakas ang base, mas maraming proton ang aalisin mula sa mga molekula ng tubig at mas mataas ang konsentrasyon ng mga hydroxide ions sa solusyon. Kaya, ang mas malakas na mga base ay nailalarawan
malalaking K value Ang mga halaga para sa ilang amin ay ibinibigay sa ibaba:

Ang mga halagang ito ay naglalarawan ng kaugnayan sa pagitan ng basicity ng mga amin at kanilang istraktura, na tinalakay sa itaas. Ang pinakamalakas na base ay pangalawang dimethylamine, at ang pinakamahina ay ang aromatic amine aniline.
Ang mga aromatic na amin ay napakahinang base dahil ang nag-iisang pares ng elektron ng nitrogen atom (na tumutukoy sa mga pangunahing katangian ng mga amine) ay nakikipag-ugnayan sa -electron cloud ng aromatic nucleus at samakatuwid ay hindi gaanong naa-access sa isang proton (o iba pang acid). Ang mas mataas na basicity ng mga pangalawang amine kumpara sa mga pangunahing ay ipinaliwanag sa pamamagitan ng katotohanan na ang mga alkyl group, dahil sa kanilang positibong inductive effect, ay nagbibigay ng mga electron sa pamamagitan ng -bond sa nitrogen atom, na nagpapadali sa pagbabahagi ng isang solong pares ng elektron. Dalawang pangkat ng alkyl ang nag-aambag ng mga electron sa nitrogen atom nang mas malakas kaysa sa isa, kaya ang pangalawang amine ay mas malakas na mga base. Batay dito, aasahan ng isa na ang mga tertiary amine ay mas matibay na base kaysa sa mga pangalawang. Gayunpaman, ang pagpapalagay na ito ay nabigyang-katwiran lamang para sa bahagi ng gas, at sa isang may tubig na solusyon ang pangunahing katangian ng mga tertiary amine ay hindi masyadong mataas. Marahil ito ay dahil sa mga epekto ng solvation.
Ang mga amine ay mahinang organikong base. Ang kanilang basicity ay tinutukoy ng bilang at likas na katangian ng mga organikong substituent na konektado sa nitrogen atom. Ang pagkakaroon ng isang mabangong singsing ay makabuluhang binabawasan ang basicity (ang halaga ng mga amin. Ang mga pangalawang amin ay mas malakas na base kaysa sa pangunahin at tersiyaryo.
Dumating si Amins sa ating buhay nang hindi inaasahan. Hanggang kamakailan lamang, ito ay mga nakakalason na sangkap, isang banggaan na maaaring humantong sa kamatayan. At ngayon, makalipas ang isang siglo at kalahati, aktibong gumagamit kami ng mga sintetikong hibla, tela, materyales sa gusali, at tina batay sa mga amin. Hindi, hindi sila naging mas ligtas, nagawa lamang ng mga tao na "paamoin" sila at pasakop sila, na nakakakuha ng ilang mga benepisyo para sa kanilang sarili. Pag-uusapan pa natin kung alin.
Kahulugan
Para sa qualitative at quantitative na pagpapasiya ng aniline sa mga solusyon o compound, isang reaksyon ang ginagamit, sa dulo kung saan ang isang puting precipitate sa anyo ng 2,4,6-tribromoaniline ay bumaba sa ilalim ng test tube.
Amines sa kalikasan
Ang mga amin ay matatagpuan sa lahat ng dako sa kalikasan sa anyo ng mga bitamina, mga hormone, at mga intermediate na metabolic na produkto ay matatagpuan pareho sa katawan ng mga hayop at sa mga halaman. Bilang karagdagan, ang pagkabulok ng mga nabubuhay na organismo ay gumagawa din ng mga daluyan ng mga amin, na sa isang likidong estado ay naglalabas ng hindi kasiya-siyang amoy ng herring brine. Ang "cadaveric poison" na malawak na inilarawan sa panitikan ay lumitaw nang tumpak salamat sa tiyak na amber ng mga amin.
Sa loob ng mahabang panahon, ang mga sangkap na aming isinasaalang-alang ay nalilito sa ammonia dahil sa kanilang katulad na amoy. Ngunit noong kalagitnaan ng ikalabinsiyam na siglo, ang French chemist na si Wurtz ay nakapag-synthesize ng methylamine at ethylamine at napatunayan na kapag nasunog ay naglalabas sila ng mga hydrocarbon. Ito ang pangunahing pagkakaiba sa pagitan ng mga nabanggit na compound at ammonia.
Produksyon ng mga amin sa mga kondisyong pang-industriya
Dahil ang nitrogen atom sa mga amin ay nasa pinakamababang estado ng oksihenasyon, ang pagbabawas ng mga compound na naglalaman ng nitrogen ay ang pinakasimpleng at pinaka-naa-access na paraan upang makuha ang mga ito. Ito ang ganitong uri na malawakang ginagamit sa pang-industriya na kasanayan dahil sa mababang halaga nito.
Ang unang paraan ay ang pagbabawas ng mga nitro compound. Ang reaksyon kung saan nabuo ang aniline ay pinangalanan ng siyentipikong Zinin at isinagawa sa unang pagkakataon sa kalagitnaan ng ikalabinsiyam na siglo. Ang pangalawang paraan ay upang bawasan ang amides gamit ang lithium aluminum hydride. Ang mga pangunahing amin ay maaari ding makuha mula sa mga nitrile. Ang pangatlong opsyon ay ang mga reaksyon ng alkylation, iyon ay, ang pagpapakilala ng mga pangkat ng alkyl sa mga molekula ng ammonia.
Paglalapat ng mga amine

Sa kanilang sarili, sa anyo ng mga purong sangkap, ang mga amin ay bihirang ginagamit. Ang isa sa mga bihirang halimbawa ay polyethylene polyamine (PEPA), na sa mga domestic na kondisyon ay nagpapadali sa pagpapatigas ng epoxy resin. Karaniwang isang pangunahin, tersiyaryo o pangalawang amine ay isang intermediate na produkto sa paggawa ng iba't ibang mga organikong sangkap. Ang pinakasikat ay aniline. Ito ang batayan ng isang malaking palette ng aniline dyes. Ang kulay na makukuha mo sa dulo ay direktang nakasalalay sa napiling hilaw na materyal. Ang purong aniline ay gumagawa ng asul na kulay, ngunit ang pinaghalong aniline, ortho- at para-toluidine ay magiging pula.
Ang mga aliphatic amines ay kinakailangan upang makagawa ng mga polyamide, tulad ng naylon at iba pa. Ginagamit ang mga ito sa mechanical engineering, pati na rin sa paggawa ng mga lubid, tela at pelikula. Bilang karagdagan, ang aliphatic diisocyanates ay ginagamit sa paggawa ng polyurethanes. Dahil sa kanilang mga pambihirang katangian (gaan, lakas, pagkalastiko at kakayahang mag-attach sa anumang ibabaw), hinihiling sila sa konstruksiyon (foam, pandikit) at sa industriya ng tsinelas (anti-slip soles).
Ang gamot ay isa pang lugar kung saan ginagamit ang mga amin. Tinutulungan ng Chemistry na i-synthesize ang mga antibiotic mula sa grupong sulfonamide mula sa kanila, na matagumpay na ginagamit bilang mga pangalawang linyang gamot, iyon ay, backup. Kung sakaling magkaroon ng resistensya ang bakterya sa mga mahahalagang gamot.
Mapanganib na epekto sa katawan ng tao
Ito ay kilala na ang mga amine ay napaka-nakakalason na mga sangkap. Ang anumang pakikipag-ugnayan sa kanila ay maaaring magdulot ng pinsala sa kalusugan: paglanghap ng mga singaw, pagkakadikit sa bukas na balat, o paglunok ng mga compound sa katawan. Ang kamatayan ay nangyayari dahil sa kakulangan ng oxygen, dahil ang mga amine (sa partikular, aniline) ay nagbubuklod sa hemoglobin sa dugo at pinipigilan ito sa pagkuha ng mga molekula ng oxygen. Ang mga nakababahalang sintomas ay igsi sa paghinga, asul na pagkawalan ng kulay ng nasolabial triangle at mga daliri, tachypnea (mabilis na paghinga), tachycardia, pagkawala ng malay.
Kung ang mga sangkap na ito ay nakukuha sa mga hubad na bahagi ng katawan, dapat mong mabilis na alisin ang mga ito gamit ang cotton wool na dati nang ibinabad sa alkohol. Dapat itong gawin nang maingat hangga't maaari upang hindi madagdagan ang lugar ng kontaminasyon. Kung lumitaw ang mga sintomas ng pagkalason, dapat kang kumunsulta sa isang doktor.
Ang aliphatic amines ay lason para sa mga nervous at cardiovascular system. Maaari silang maging sanhi ng depresyon ng paggana ng atay, dystrophy ng atay, at maging ng kanser sa pantog.